题目内容
【题目】某校化学兴趣小组利用电解水、氢气燃烧、氢气还原氧化铜三组实验装置分别测定水的组成,其中图二、图三中反应所需的氢气来自实验室制氢气装置。(资料:实验室用锌粒和20%的硫酸溶液反应制取氢气,反应方程式为Zn+H2SO4![]() ZnSO4+H2↑)
ZnSO4+H2↑)
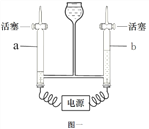
(1)按左上图一实验,写出电解水反应方程式_______,b管中产生的气体是 _______。
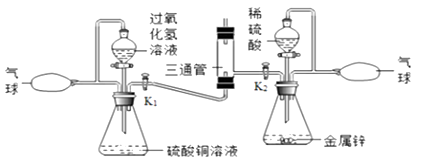
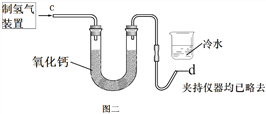
(2)按右上图二实验,图二U型管中氧化钙的作用是_______________ , 在d处点燃氢气,证明水的组成的现象是_______________________________________。
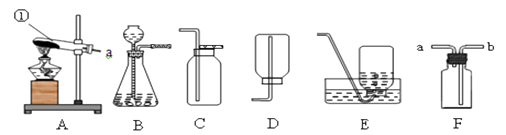
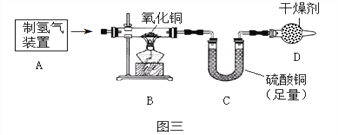
(3)按下图三实验,B装置中反应的化学方程式为______________________, C装置中的现象是 ______________。若实验测得B装置实验前后减少了3.2克,C增加了4.0克,根据实验数据计算出水中氢氧元素质量比为1:4,大于实际结果1:8,可能的原因是_______________。若B中仍有黑色固体,则实验结果_____________( 偏大,偏小,无影响),图三实验装置中D装置的作用是__________________。
【答案】 2H2O ![]() 2H2↑+O2↑ 氧气(O2) 吸收氢气从溶液中带出的水分(干燥氢气等合理给分) d处产生淡蓝色的火焰,烧杯底部有小液滴(只有d处现象不得分) H2 + CuO
2H2↑+O2↑ 氧气(O2) 吸收氢气从溶液中带出的水分(干燥氢气等合理给分) d处产生淡蓝色的火焰,烧杯底部有小液滴(只有d处现象不得分) H2 + CuO![]() Cu + H2 O 白色粉末变蓝 氢气从溶液中带出的水分,使C装置吸收的水分质量偏大,造成计算出的氢元素质量偏大(合理给分) 无影响 阻止空气中的水分进入C装置影响实验结果
Cu + H2 O 白色粉末变蓝 氢气从溶液中带出的水分,使C装置吸收的水分质量偏大,造成计算出的氢元素质量偏大(合理给分) 无影响 阻止空气中的水分进入C装置影响实验结果
【解析】本题考查了利用电解水、氢气燃烧、氢气还原氧化铜三组实验装置分别测定水的组成,电解水、氢气燃烧是利用质量守恒定律得到水的组成,氢气燃烧时,要用干燥的氢气燃烧才能得到正确的结果,氢气还原氧化铜,测定B中氧化铜和C中干燥剂反应前后的质量,B中氧化铜反应前后的质量减少,减少的质量就是氧化铜中失去的氧元素的质量,即生成的水中氧元素的质量;C中干燥剂反应前后质量增重,增重的质量即为生成的水的质量。
(1)电解水时生成了氧气和氢气,反应方程式是:2H2O ![]() 2H2↑+O2↑,b管中产生的气体体积小于a管,b管中产生的气体是氧气(O2);
2H2↑+O2↑,b管中产生的气体体积小于a管,b管中产生的气体是氧气(O2);
(2)右上图二实验要证明有水生成,实验室制得的氢气中含有水,要除去水;氧化钙能与水反应,图二U型管中氧化钙的作用是吸收氢气从溶液中带出的水分(干燥氢气等),在d处点燃氢气,氢气燃烧时产生淡蓝色火焰,生成水,证明水的组成的现象是d处产生淡蓝色的火焰,烧杯底部有小液滴。
(3)图三实验,B装置中氢气与氧化铜在加热时生成了铜和水,反应的化学方程式为H2 + CuO![]() Cu + H2 O, 硫酸铜遇水变蓝色,C装置中的现象是白色粉末变蓝。氢气还原氧化铜生成铜和水,减少的固体的质量就是氧化铜中含有的氧元素的质量,氧元素的质量为3.2g,C装置吸收的是水,故水的质量为4g,所以氢元素的质量为4g-3.2g=0.8g,所以氢元素和氧元素的质量比为:0.8g:3.2g=1:4,计算的结果氢元素的质量偏大,可能时水的质量测量偏大,可能是氢气从溶液中带出的水分,使C装置吸收的水分质量偏大,造成计算出的氢元素质量偏大;实验结束后,无论B处是否仍有黑色固体,对实验测定的水中氢氧元素的质量比无影响,这是因为计算水中氢氧元素的质量比时,利用的是B中减少的质量和C中增加的质量,与氧化铜是否完全反应无关;图三实验装置中D装置中的干燥剂能吸收水,能阻止空气中的水分进入C装置影响实验结果。
Cu + H2 O, 硫酸铜遇水变蓝色,C装置中的现象是白色粉末变蓝。氢气还原氧化铜生成铜和水,减少的固体的质量就是氧化铜中含有的氧元素的质量,氧元素的质量为3.2g,C装置吸收的是水,故水的质量为4g,所以氢元素的质量为4g-3.2g=0.8g,所以氢元素和氧元素的质量比为:0.8g:3.2g=1:4,计算的结果氢元素的质量偏大,可能时水的质量测量偏大,可能是氢气从溶液中带出的水分,使C装置吸收的水分质量偏大,造成计算出的氢元素质量偏大;实验结束后,无论B处是否仍有黑色固体,对实验测定的水中氢氧元素的质量比无影响,这是因为计算水中氢氧元素的质量比时,利用的是B中减少的质量和C中增加的质量,与氧化铜是否完全反应无关;图三实验装置中D装置中的干燥剂能吸收水,能阻止空气中的水分进入C装置影响实验结果。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案