题目内容
 (1)碘酒溶液中溶质是
(1)碘酒溶液中溶质是碘
碘
,溶剂是酒精
酒精
;(2)下列溶液中一定是饱和溶液的是
B
B
(填序号);A.无色透明溶液 B.含有未溶氯化钠固体的氯化钠溶液
C.紫红色透明溶液 D.将硝酸钾溶液降温析晶后所得溶液
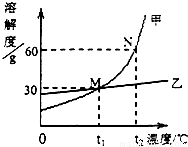
(3)将甲、乙两固体溶解于水中,其溶解度曲线如图所示,
①N点所表示的含义是
甲物质在t2℃时,其溶解度为60克
甲物质在t2℃时,其溶解度为60克
;②t2℃时,甲物质的饱和溶液的质量分数为
37.5%
37.5%
;③t1℃时,甲物质饱和溶液的质量分数
=
=
(填“>”、“<”或“=”)乙物质饱和溶液的质量分数;④若甲和乙的混合溶液中含有少量乙物质,则提取甲物质的方法是
降温结晶
降温结晶
;(4)用10g 98%的硫酸溶液(体积约为5mL)加入到90g水(体积为90mL)中,则所得硫酸溶液的质量分数为
9.8%
9.8%
;按上述要求配制好溶液后,实际测得溶液的体积小于95mL,配制前后溶液体积并不守恒,其原因是分子之间有间隔
分子之间有间隔
.分析:根据溶解度曲线横、纵坐标分别表示的意义,明确曲线的趋势、陡度及其含义,理解曲线上的点和曲线之间的交点所表示的意义.整合溶液的相关知识,能结合设置的问题情景来解决该问题.
解答:解:(1)碘酒溶液中溶质是碘,溶剂是酒精;
(2)根据溶液的概念回答,故下列溶液中一定是饱和溶液的是含有未溶氯化钠固体的氯化钠溶液;
(3)将甲、乙两固体溶解于水中,其溶解度曲线如图所示,
①N点所表示的含义是 甲物质在t2℃时,其溶解度为60克;
②t2℃时,甲物质的饱和溶液的质量分数为
×100%=37.5%;
③在溶解度曲线图中,曲线的交点表示该温度下,两种物质的溶解度相同,所以,曲线中P点表示在t1℃时甲、乙两物质的溶解度相等;
④曲线的陡度表示物质的溶解度受温度的影响情况,陡度愈大,受温度影响越大,陡度越小,受温度的影响较小.由图象可知,甲受温度影响大,乙受温度影响小,所以甲物质中混有少量乙物质时,降温结晶主要析出甲.因此甲物质中混有少量乙物质时,可采用降温结晶的方法得到较纯净的甲物质.
(4)根据溶液稀释前后溶质质量不变进行分析.根据分子的基本性质回答.
故答为:(1)碘,酒精;
(2)B;
(3)①甲物质在t2℃时,其溶解度为60克;②37.5%;③=;④降温结晶.
(4)9.8%;分子之间有间隔
(2)根据溶液的概念回答,故下列溶液中一定是饱和溶液的是含有未溶氯化钠固体的氯化钠溶液;
(3)将甲、乙两固体溶解于水中,其溶解度曲线如图所示,
①N点所表示的含义是 甲物质在t2℃时,其溶解度为60克;
②t2℃时,甲物质的饱和溶液的质量分数为
| 60 |
| 60+100 |
③在溶解度曲线图中,曲线的交点表示该温度下,两种物质的溶解度相同,所以,曲线中P点表示在t1℃时甲、乙两物质的溶解度相等;
④曲线的陡度表示物质的溶解度受温度的影响情况,陡度愈大,受温度影响越大,陡度越小,受温度的影响较小.由图象可知,甲受温度影响大,乙受温度影响小,所以甲物质中混有少量乙物质时,降温结晶主要析出甲.因此甲物质中混有少量乙物质时,可采用降温结晶的方法得到较纯净的甲物质.
(4)根据溶液稀释前后溶质质量不变进行分析.根据分子的基本性质回答.
故答为:(1)碘,酒精;
(2)B;
(3)①甲物质在t2℃时,其溶解度为60克;②37.5%;③=;④降温结晶.
(4)9.8%;分子之间有间隔
点评:本题应用溶解度曲线的画法、意义、作用,从溶解度曲线中获取有价值的信息.根据曲线的横、纵坐标分别表示什么意义,明确曲线的趋势、陡度及其含义,理解曲线上的点和其它位置的点所表示的意义,来解答题目.锻炼了创新思维和整合知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 溶液在生产和生活中有重要意义.
溶液在生产和生活中有重要意义. (1)碘酒溶液中溶质是______,溶剂是______;
(1)碘酒溶液中溶质是______,溶剂是______;