题目内容
【题目】向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。则下列说法正确的是( )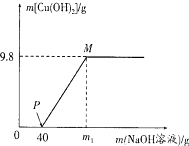
A.整个反应过程中,溶液中氯离子个数不变
B.PM段的溶液中加入铁粉,会产生气泡
C.M点溶液中氯化钠的质量分数为8.3%
D.沉淀完全时,m1的数值为80
【答案】A,C
【解析】化学反应过程只是原子重新组合的过程,反应前后原子的种类、个数不变。向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,氢氧化钠和氯化铜反应生成氢氧化铜和氯化钠,盐酸和氢氧化钠反应生成氯化钠和水。
A、因为只生成氢氧化铜沉淀,故A选项整个反应过程中,氯离子个数都存在于溶液中,所以溶液中氯离子个数不变,A符合题意;
B、向混合物中加入氢氧化钠时,盐酸先和氢氧化钠反应,所以P点溶液中的溶质有两种氯化钠和氯化铜,PM段的溶液中加入铁粉,发生的反应是铁和氯化铜生成铜和氯化亚铁,所以不会产生气泡,B不符合题意;
C、 设氢氧化钠和盐酸反应生成氯化钠的质量为x
NaOH+ HCl = | NaCl+ H2O |
40 | 58.5 |
40g×10% | x |
![]() =
=![]() ,x=5.85g;
,x=5.85g;
设氢氧化钠和氯化铜反应生成氯化钠的质量为y
2NaOH+ CuCl2= | Cu(OH)2↓+ | 2NaCl |
80 | 98 | 117 |
z | 9.8g | y |
98/9.8g=117/y , y=11.7g;
98/9.8g=80/z, z=8g ;
和氯化铜反应的氢氧化钠溶液的质量为:8g÷10%=80g;
M点氯化钠的质量为11.7g+5.85g=17.55g,
M点溶液的质量为40g+80g+100g-9.8g=210.2g,
M点溶液中氯化钠的质量分数为17.55g÷210.2g ×100%≈8.3%;
D. 沉淀完全时,m1的数值为80g+40g=120g;
所以答案是:AC。
【考点精析】认真审题,首先需要了解质量守恒定律及其应用(①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏).

 名校课堂系列答案
名校课堂系列答案【题目】下列除去杂质的方法中,正确的是( )
选项 | 物质 | 杂质 | 除杂质的方法 |
A | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |
B | KCl | MnO2 | 加适量水溶解、过滤、蒸发 |
C | CO2 | CO | 将气体通入足量氢氧化钠溶液 |
D | 银粉 | 锌粉 | 加入过量硫酸亚铁溶液,过滤 |
A.AB.BC.CD.D