题目内容
【题目】下列实验过程与下图所示描述相符合的一组是( )

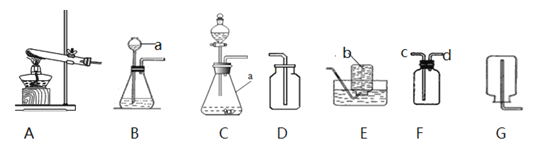
A. 镁带在耐高温的密闭容器(含空气)中加热,所盛物质质量的变化;
B. 表示水的电解;
C. 加热2份等质量的氯酸钾,其中一份加入MnO2;
D. 碳酸钠与稀盐酸在烧杯中反应;
【答案】D
【解析】
A. 由质量守恒定律可知反应前后物质的总质量不变,镁带在耐高温的密闭容器(含空气)中加热,所盛物质质量应不变,选项错误;B. 电解水时氢气和氧气的体积比为2:1,选项错误;C. 催化剂只改变反应速率,不改变生成物的质量,加热2份等质量的氯酸钾,其中一份加入MnO2;二者生成氧气的量一样多,加二氧化锰的反应快,不加二氧化锰的反应慢,但都需要加入一段时间后开始生成氧气,选项错误;D. 碳酸钠与稀盐酸在烧杯中反应,生成二氧化碳逸出,所以剩余物质的质量比反应前少,但大于零,选项正确。故选D。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
【题目】小明设计了如下图所示的实验装置来证明氧化铜能加快过氧化氢溶液的分解,并与相同条件下![]() 的催化效果做比较,实验时间均以生成
的催化效果做比较,实验时间均以生成![]() 气体为准(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
气体为准(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
实验序号 | 过氧化氢溶液体积 | 催化剂 | 待测数据 |
① |
| 无 | |
② |
| 氧化铜 | |
③ |
|
|
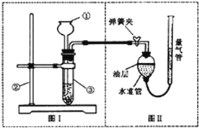
![]() 图中油层的作用是________
图中油层的作用是________
![]() 从设计原理看,实验中的“待测数据”可以是指________.
从设计原理看,实验中的“待测数据”可以是指________.
![]() 为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意________(填字母编号).
为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意________(填字母编号).
![]() .视线与凹液面最低处相平
.视线与凹液面最低处相平
![]() .读数前不能移动量气管和水准管
.读数前不能移动量气管和水准管
![]() .保持水准管静止,待水准管中液面不再上升时,立刻读数
.保持水准管静止,待水准管中液面不再上升时,立刻读数
![]() .读数前应上下移动水准管,待两管液面相平再读数
.读数前应上下移动水准管,待两管液面相平再读数
![]() 如果要进一步探究氧化铜是否是该反应的催化剂,请完成下列实验.
如果要进一步探究氧化铜是否是该反应的催化剂,请完成下列实验.
实验步骤和现象 | 设计这一步骤的目的 |
| 氧化铜能够加快过氧化氢溶液的分解 |
________________ | ________________ |
________________ | ________________ |