题目内容
实验室有一瓶未开封的浓盐酸,标签部分内容如右下图所示,请回答下列问题.
| 化学纯 盐酸 含HCl 37% 密度1.18g?cm-3 容量 500mL XX化学试剂厂 |
(2)若用这瓶浓盐酸来配制200g溶质质量分数为7.3%的稀盐酸,需取浓盐酸的质量是________g;
(3)取适量该稀盐酸与含碳酸钙90%的石灰石反应制取4.4g二氧化碳,反应后所得溶液中溶质的质量分数是________(杂质既不与盐酸反应,又不溶于水).
解:(1)浓盐酸的溶液质量=溶液体积×密度,即浓盐酸的溶液质量=500×1.18=590(g);
(2)浓盐酸的质量=200×7.3%÷37%≈39.5(g);
(3)设溶液中含CaCl2为x,H2O为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 18 44
xg yg 4.4g
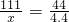 ,解得x=11.1(g)
,解得x=11.1(g)
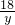 =
= ,解得y=1.8(g)
,解得y=1.8(g)
溶液的质量=11.1+1.8=12.9(g)
溶质的质量分数=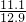 ×100%=86%
×100%=86%
答案为:(1)590;(2)39.5;(3)86%
分析:(1)溶液的质量=溶液的体积×溶液的密度;
(2)溶质的质量(浓盐酸的质量)=配制溶液的质量×配制溶液的质量分数÷原溶液的质量分数;
(3)根据化学反应方程式找出CaCl2、H2O、CO2间的关系,然后列算式计算.
点评:本题主要考查的是溶质的质量分数的简单计算及根据化学反应方程式的计算的知识.
(2)浓盐酸的质量=200×7.3%÷37%≈39.5(g);
(3)设溶液中含CaCl2为x,H2O为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 18 44
xg yg 4.4g
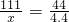 ,解得x=11.1(g)
,解得x=11.1(g)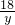 =
= ,解得y=1.8(g)
,解得y=1.8(g)溶液的质量=11.1+1.8=12.9(g)
溶质的质量分数=
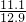 ×100%=86%
×100%=86%答案为:(1)590;(2)39.5;(3)86%
分析:(1)溶液的质量=溶液的体积×溶液的密度;
(2)溶质的质量(浓盐酸的质量)=配制溶液的质量×配制溶液的质量分数÷原溶液的质量分数;
(3)根据化学反应方程式找出CaCl2、H2O、CO2间的关系,然后列算式计算.
点评:本题主要考查的是溶质的质量分数的简单计算及根据化学反应方程式的计算的知识.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
实验室有一瓶未开封的浓盐酸,部分标签如图所示.这瓶浓盐酸中溶液的质量为 g.若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是 mL,需加水 毫升.若用俯视量取水,则造成质量分数 (填>、=、<)10%.
| 化学纯 盐酸 含HCl 37% 密度1.18g?cm-3 容量 500mL XX化学试剂厂
实验室有一瓶未开封的浓盐酸,标签部分内容如图所示,请回答下列问题.
|
 实验室有一瓶未开封的浓盐酸,部分标签如图所示.这瓶浓盐酸中溶液的质量为
实验室有一瓶未开封的浓盐酸,部分标签如图所示.这瓶浓盐酸中溶液的质量为 实验室有一瓶未开封的浓盐酸,部分标签如右图所示.这瓶浓盐酸的质量为
实验室有一瓶未开封的浓盐酸,部分标签如右图所示.这瓶浓盐酸的质量为 实验室有一瓶未开封的浓盐酸,部分标签如图所示.
实验室有一瓶未开封的浓盐酸,部分标签如图所示.