题目内容
(3分)某小组利用实验数据,求算金属M的相对原子质量。已知金属M和硫酸反应的化学方程式为: M + H2SO4 ="=" MSO4 + H2↑。
现取20 g该金属样品于烧杯中,然后向其中加入稀硫酸,实验数据记录如下:
第5次实验后,烧杯中还有0.5 g剩余固体。计算该金属的相对原子质量。
现取20 g该金属样品于烧杯中,然后向其中加入稀硫酸,实验数据记录如下:
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| 加入硫酸的质量/g | 100 | 200 | 300 | 400 | 500 |
| 烧杯中剩余物质量/g | 119.8 | 219.6 | 319.4 | 419.4 | 519.4 |
65
试题分析:解:20 g该金属样品中最后还有0.5 g剩余固体不能参加反应,参加反应的金属质量="20" g – 0.5 g ="19.5" g
生成氢气的质量500 g + 20 g - 519.4 g =" 0.6" g
设该金属的相对原子质量为x
M + H2SO4 ="=" MSO4 + H2↑
x 2
19.5 g 0.6 g
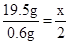
x=65
答:该金属的相对原子质量为65
点评:解答本题的关键是通过表中数据分析,得出参加反应的金属质量和反应生成的氢气的质量;根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 LiOH + H2↑ 。若制取10 g氢气,需要消耗多少克氢化锂?
LiOH + H2↑ 。若制取10 g氢气,需要消耗多少克氢化锂?