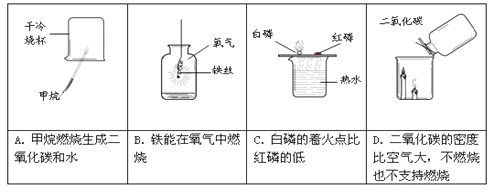
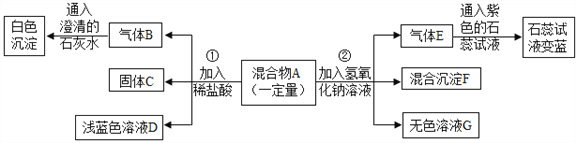
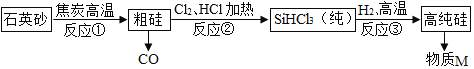
题目内容
【题目】(一)铁的应用和防护
【1】我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______________。
【2】铁生锈的主要过程为
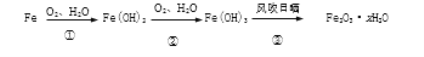
(1)写出转化①的化学方程式________________________
(2)转化③生成Fe2O3·xH2O,则x≤____________(x为整数)。
【3】请提出防止铁生锈的一条措施________________________________。
【答案】
【1】 Fe+CuSO4 =FeSO4+Cu
【2】 2Fe+O2+2H2O=2Fe(OH)2 3
【3】 保持金属制品表面的清洁干燥(或刷漆或镀一层防锈金属等)。
【解析】
铁生锈是一个复杂的化学变化,从质量守恒定律着手进行分析,问题即可解决。
【1】“曾青得铁则化为铜”用化学方程式表示是:Fe+CuSO4 =FeSO4+Cu
【2】(1)化学反应遵守质量守恒定律,反应前后各种原子个数相等,故转化①的化学方程式:2Fe+O2+2H2O=2Fe(OH)2(2)氢氧化铁沉淀在空气中分解生成氧化铁和水,2Fe(OH)3===Fe2O3+3H2O,在转化为结晶水时,水的质量可能变小,所以转化③生成Fe2O3·3H2O,则x≤3。
【3】铁生锈的条件是铁与氧气、水同时接触,保持金属制品表面的清洁干燥或在铁制品表面刷漆或涂油或镀一层防锈金属都可以防止铁制品生锈。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目