题目内容
【题目】下面是某校学生进行“金属的物理性质和化学性质”的实验活动:
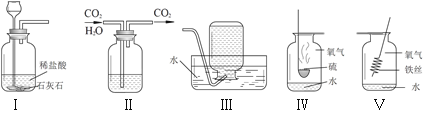
(1)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则黄铜的硬度_____(填“>””<”或“=”)纯铜的硬度。
(2)同学收集到的金属制品有硬币、铝质导线、铜质火锅、小刀等,其中利用金属导热性的是_____。
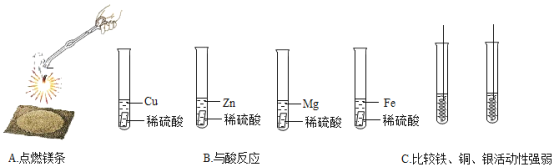
(3)实验A中可观察到的现象为_____;实验B中,_____与酸反应最快。
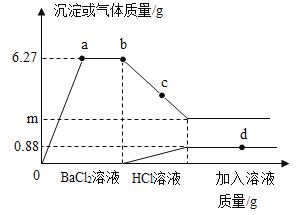
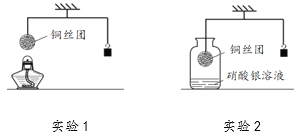
(4)实验C中,小云同学选择一种金属丝放入两种不同溶液中,则所用的金属是_____;其中发生反应的化学方程式为_____,发生反应后该金属丝的质量_____(填“变大”“减小”或“不变”)
【答案】> 铜质火锅 发出耀眼的白光,放出大量的热,生成白色粉末状物质 镁 铜 2AgNO3+Cu=Cu(NO3)2+2Ag 变大
【解析】
(1)将黄铜片和纯铜片相互刻画,纯铜片表面留下较深的划痕,说明黄铜的硬度大于纯铜硬度;
(2)硬币利用抗腐蚀性、延展性;铝质导线利用导电性;铜质火锅利用导热性;小刀利用硬度大,故选铜质火锅。(3)镁条燃烧发出耀眼的白光,放出大量的热,生成白色粉末状物质;实验B中,镁的活动性最强,与酸反应最快。
(4)实验C中,比较铁、铜、银的活动性顺序,可将铜分别放入氯化亚铁和硝酸银溶液中,铜与氯化亚铁不能反应,说明铁的活动性大于铜,铜与硝酸硝酸银反应,说明铜的活动性大于银,发生反应的化学方程式为2AgNO3+Cu=Cu(NO3)2+2Ag,根据化学方程式可知,每64份质量的铜可生成216份质量的银,故反应后该金属丝的质量变大。

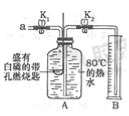
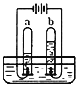
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验.
【实验一】(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检验装置的气密性,气密性良好. 步骤Ⅱ.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧. 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧. 步骤Ⅳ.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧. |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2,如果观察到 ,说明空气中氧气的体积约占![]() .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于![]() ,原因可能是 (答一条即可).
,原因可能是 (答一条即可).
【实验二】用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量.若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由 .【已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿.化学方程式:2Cu+O2+H2O+CO2═Cu(OH)2CO3】