题目内容
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3。工业上从铝土矿中提取铝可采用如下工艺流程:
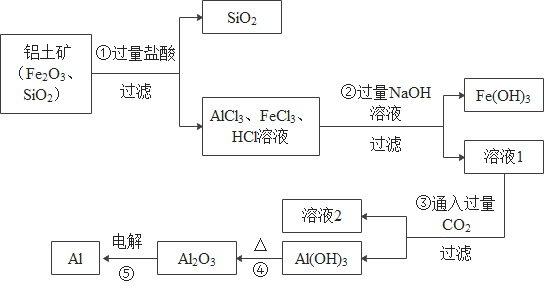
请回答下列问题:
(1)请写出反应①中发生的一个反应的化学方程式________________。
(2)反应②除生成Fe (OH)3外,还生成了偏铝酸钠(NaAlO2), 溶液1中通入过量二氧化碳,生成氢氧化铝和另一种生活中常见的盐,已知两种生成物的质量比为78:84,请写出反应③的化学方程式___________。
(3)反应⑤中还生成了一种气体单质,请写出该反应的化学方程式________________。
【答案】Fe2O3+6HCl=2FeCl3+3H2O(或Al2O3+6HCl=2AlCl3+3H2O) NaAlO2+CO2+2H2O=Al(OH)3![]() +NaHCO3 2Al2O3
+NaHCO3 2Al2O3![]() 4Al+3O2
4Al+3O2![]()
【解析】
(1)铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,向其中加入过量的盐酸,盐酸与氧化铁反应生成氯化铁和水,与氧化铝反应生成氯化铝和水,化学方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,故填写:Fe2O3+6HCl=2FeCl3+3H2O(或Al2O3+6HCl=2AlCl3+3H2O);
(2)偏铝酸钠(NaAlO2)溶液中通入过量二氧化碳,生成氢氧化铝和另一种生活中常见的盐,根据质量守恒定律实质:化学反应前后,元素种类不变可知,反应生成物中有氢氧化铝,其中含有氢元素,因此,反应物中也含有氢元素,偏铝酸钠和二氧化碳中没有氢元素,因此,反应物必有三种,分别为:偏铝酸钠、二氧化碳和水,生成物除了氢氧化铝,含有另一种生活中常见的盐是钠盐,根据生成物的质量比为78:84,氢氧化铝的相对分子质量为78,则钠盐的相对分子质量为84,为碳酸氢钠,因此,反应③的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3![]() +NaHCO3,故填写:NaAlO2+CO2+2H2O=Al(OH)3
+NaHCO3,故填写:NaAlO2+CO2+2H2O=Al(OH)3![]() +NaHCO3;
+NaHCO3;
(3)根据质量守恒定律的实质可知,反应⑤生成的气体单质是氧气,故填写:2Al2O3![]() 4Al+3O2
4Al+3O2![]() 。
。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
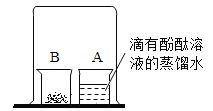
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
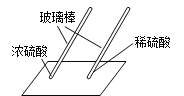
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
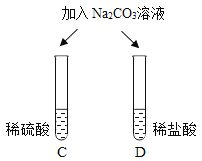
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
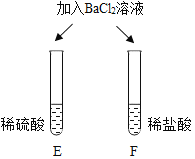
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验图1
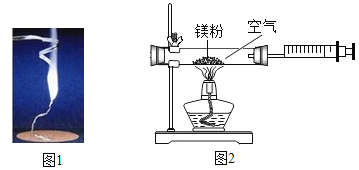
(1)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量.待镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条的质量小,出现此现象的原因是_______________。
小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,难溶于水且不与水反应;
②镁能与氮气反应只生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应,反应的化学方程式为![]()
④氢氧化镁是不溶于水的固体,且受热易分解生成氧化镁和水
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B
| (2)现象:________________ 结论:燃烧产物含Mg3N2 |
[拓展延伸]
(3)如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数_______1/5 (填“大于”、“小于”或“等于”)
(4)请选择下列正确的实验方案将混在氧化镁中的氮化镁除去____________
A将混合物直接蒸馏
B将混合物直接过滤
C将混合物溶于水,待充分反应后过滤,再将滤渣在常温下干燥.
D将混合物溶于水,待充分反应后过滤,再将滤渣充分加热至固体质量不再变化
(5)将足量的镁条放在含氮气和氧气质量比为7: 2的混合气体中充分燃烧反应,再将生成的固体物质与足量水反应产生气体质量为34g,求消耗镁条的质量为______________