题目内容
【题目】某白色固体甲的主要成分为NaCl,可能含有MgCl2、KCl、BaCl2和NaOH中的一种或几种杂质,为检验白色固体甲的成分并除去其中杂质,进行如下实验:
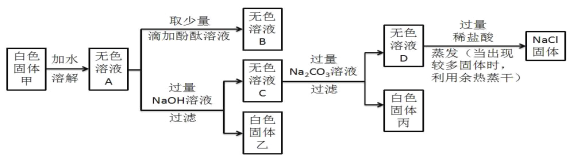
(1)写出生成白色固体丙的化学方程式____________;
(2)向无色溶液D中加入过量稀盐酸的目的是____________;
(3)分析上述实验可知,白色固体甲中一定没有的物质是____________;
(4)若用上述实验中的A、B、C、D四种溶液鉴别稀H2SO4和NaOH溶液,分别取样后,按下图所示操作进行实验,就能达到鉴别目的的是实验____________。

【答案】 BaCl2+Na2CO3=BaCO3↓+2NaCl 除去过量的NaOH 和Na2CO3 NaOH 2,3,4
【解析】
向无色溶液中加入酚酞,溶液颜色没有发生变化,说明溶液中一定没有NaOH,向溶液A 中加入过量的氢氧化钠,有白色沉淀生成,说明溶液中一定有氯化镁,向无色溶液中加入碳酸钠,有白色沉淀生成,说明溶液中一定有氯化钡,故混合物中一定含有MgCl2、BaCl2,可能含有KCl,一定不含有氢氧化钠。(1)由图可知,白色固体丙是碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,反应方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl;
(2)无色溶液D中含有过量的氢氧化钠和碳酸钠和氯化钠,故加入过量的稀盐酸是除去过量的NaOH和Na2CO3;
(3)由上分析可知,白色固体甲中一定没有的物质是氢氧化钠;
(4)A.无色溶液A中一定有氯化镁、氯化钡,可能含有氯化钾,氯化镁可以与氢氧化钠反应有白色沉淀生成,氯化钡可以与稀硫酸反应生成硫酸钡沉淀,故现象相同,不能鉴别; B.无色溶液B中一定有氯化镁、氯化钡、酚酞,可能有氯化钾,分别将无色溶液B加入稀硫酸和氢氧化钠中后,氢氧化钠变红,而稀硫酸不能变红,故可以鉴别; C. 无色溶液A中加入过量的氢氧化钠后,氢氧化钠与氯化镁反应生成了氢氧化镁沉淀和氯化钠,故无色溶液C中含有氯化钡、氢氧化钠和氯化钠,可能含有氯化钾,将溶液C加入稀硫酸和氢氧化钠中后,稀硫酸中有白色沉淀生成,而氢氧化钠溶液无明显现象,故可以鉴别;
D.无色C溶液中加入过量的碳酸钠后,碳酸钠可以与氯化钡反应生成碳酸钡沉淀和氯化钠,故所得溶液D中一定含有氢氧化钠、碳酸钠、氯化钠,可能含有氯化钾,将D溶液加入稀硫酸和氢氧化钠溶液中后,稀硫酸溶液先无气泡,后有气泡冒出,氢氧化钠溶液无明显现象,故可以鉴别;故选2,3,4。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案