题目内容
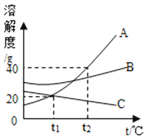
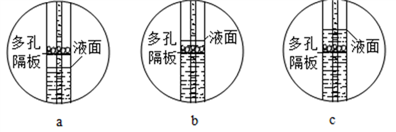
【题目】按下图装置进行实验,倾斜锥形瓶使足量稀盐酸全部倒入,并与固体接触发生反应,瓶内气压的变化如坐标图所示。下列说法错误的是

A. 块状碳酸钙反应速率较快
B. a点所对应的体系中含有CaCl2和HCl
C. 1 g碳酸钙完全反应后,可获得0.44g 二氧化碳
D. 对比分析坐标图中的a、c点或b、d点,可知化学反应速率与反应物的接触面积有关
【答案】A
【解析】A、由图像可知,块状碳酸钙反应速率较慢,错误;B、由图像可知,a点压强在增加的过程中,稀盐酸与粉末状碳酸钙发生反应且稀盐酸未反应完,故a点所对应的体系中含有稀盐酸与碳酸钙反应生成的CaCl2和过量的HCl,正确;C、设1g碳酸钙完全反应后生成二氧化碳的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
0.1g x
![]()
x=0.44g,正确;D、对比分析坐标图中的a、c点可知,两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短;对比分析坐标图中的b、d点可知,在相同时间内,碳酸钙粉末与稀盐酸反应使锥形瓶内压强增加更快。故对比分析坐标图中的a、c点或b、d点,可知化学反应速率与反应物的接触面积有关,正确。故选A。

【题目】某化学实验小组对 “影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
[进行实验]室温下,选用20mL不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________________。
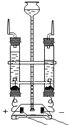
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是____。
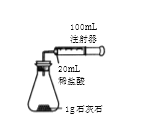
开始实验时,应将20mL稀盐酸_____________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
[处理数据](3)实验小组进行实验后,获得的相关实验数据如表所示:
实验 编号 | 盐酸的溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳的体积/mL (均收集前30s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是_______(写一组),由此可得到的结论是_______________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_____________。
(4)如表是实验时记录生成的二氧化碳气体的体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 3 | 36 | 40 | |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变____,其主要原因是___。
(5)你认为影响石灰石与盐酸反应速率的因素还有____,请设计实验方案验证你的猜想:____
【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的研究。
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是______;②是CaCl2。
(2)【设计实验】同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加________ | ________________ | 猜想①正确 |
则碳酸钠溶液与M溶液反应的方程式为_____________________。
探究二:过滤后澄清滤液中会有哪些溶质?
(1)【提出猜想】猜想一:NaOH 和Na2CO3;猜想二:__________;猜想三:NaOH。
(2)【实验验证】同学们针对“猜想一”进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
取样于试管中,滴加少量的稀盐酸 | 无气体产生 | 猜想一不成立 |
他们的实验结论是否正确?________,理由是_________________。
(3)【继续探究】设计实验方案确定滤液中溶质的组成。
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入____________溶液 | __________________ | 猜想三成立 |