题目内容
【题目】液化石油气和天然气都是家庭常用燃料,液化石油气的主要成分是丙烷、丁烷、丙烯和丁烯,天然气的有效成分是甲烷。
(1)若320g甲烷充分燃烧,消耗氧气的质量是多少克?_____(请写出计算过程)
(2)假设液化石油气只以丙烷(C3H8)计算,等质量的丙烷和甲烷充分燃烧,耗氧量更大的是_____,若从液化石油气改用天然气,则炉具的进风口要_____(选填“调大”或“调小”、“不改变”)。
(3)某同学想了解使用液化石油气和天然气哪个更划算,他查阅资料如下:
燃气 | 价格 | 热值 |
液化石油气 | 125元/瓶(13Kg/瓶) | 45兆焦/Kg |
天然气 | 4. 6元/立方米 | 33.4兆焦/立方米 |
由此可知使用_____更划算。
【答案】1280g 甲烷 调小 天然气
【解析】
解:(1)设:消耗氧气的质量为x。
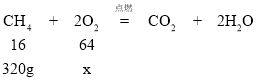
![]() x=1280g
x=1280g
消耗氧气的质量为1280g;
(2)C3H8在空气中完全燃烧产生二氧化碳和水的化学方程式是: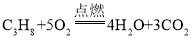 ;320g丙烷消耗氧气的质量=
;320g丙烷消耗氧气的质量=![]() ,小于1280g,则等质量的丙烷和甲烷充分燃烧,耗氧量更大的是甲烷;
,小于1280g,则等质量的丙烷和甲烷充分燃烧,耗氧量更大的是甲烷;
在同温同压下,相同体积的任何气体中含有的分子数相同。一个丙烷分子与5个氧分子反应;1个甲烷分子与2个氧分子反应,原使用液化石油气的用户,在改进天然气作燃料时,如果进燃气管的直径不变,改造后的燃气灶与原来相比,进空气管的直径应调小;
(3)购买125元天然气完全燃烧产生的热量为=![]() ;
;
购买125元液化石油气完全燃烧产生的热量为=13Kg×45兆焦/Kg=585兆焦;
使用天然气更划算。

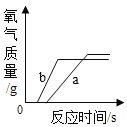
【题目】下列图像能正确反映对应的变化关系的是
|
|
|
|
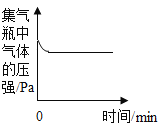
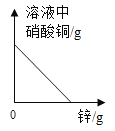
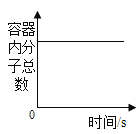
A向a.b两支试管中分别加入等质量的样品,a中是氯酸钾,b中是氯酸钾和少量二氧化锰 | B利用红磷燃烧测定空气中氧气的含量(打开止水夹前) | C向一定质量AgNO3和Cu(NO3)2的混和溶液中逐渐加入足量的锌粒 | DCO和过量的氧气在密闭容器中完全反应 |
A.AB.BC.CD.D
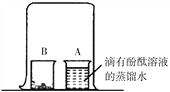
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图1)。
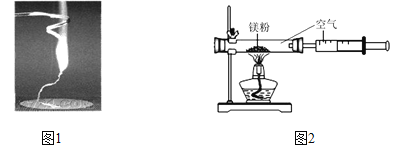
(1)请写出镁条与氧气反应的化学方程式___________________。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是 __________________________。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【做出猜想】黄色固体为Mg3N2
【实验探究】
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:_______________。 结论:燃烧产物中含Mg3N2 |
【反思与交流】
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。
___________________________________________________。
②空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释____________________。
【拓展延伸】
①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量可能是______。
A. 3.33g B. 4.00g C. 3.28g D. 3.96g
【题目】(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。 限选控制反应速率的方法:①反应物的浓度 ②反应物的状态
限选试剂:A.稀盐酸 B.浓盐酸 C.块状石灰石 D.碳酸钠溶液 E.粉末状石灰石
填写下表并回答相关问题
实验名称 | 控制速率的方法 | 所选用的最佳试剂 |
灭火器反应原理 | ① | ___________和D |
CO2的实验室制法 | ___________; | A和C |
写出实验室制备CO2的化学反应方程式:______________________。
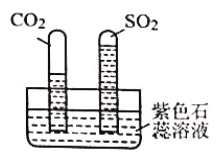
(2)己知:CO2和SO2既有相似性,又有差异性。
实验:水槽中滴入紫色石蕊溶液,将收集满两种气体的试管同时倒立于水槽中,片刻后实验现象如下图所示,说明相同条件下的溶解性:SO2 ___________(填“>”或“<”)CO2,试管内溶液变成___________色。