题目内容
向10克溶质的质量分数为2%的苛性钠溶液中逐滴加入10克溶质的质量分数为2%的盐酸,反应过程中溶液的pH随加入盐酸质量(mHCl)的变化符合下列图示的是
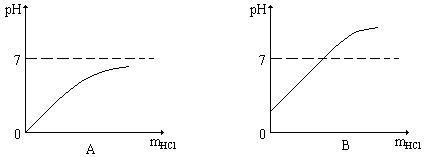
A

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
 在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
I、他们首先配制实验所需的50mL、6%的H2O2溶液.
[配制溶液]
现有一瓶新购置的双氧水,标签如图所示.
(1)若用这瓶双氧水来配置6%的医用双氧水1500g,需要这种双氧水的质量是多少克?
(2)另有一瓶5个月前购进的相同规格的双氧水,经检测,已缓慢分解放出了9.6g氧气,求现在剩余的该瓶溶液中溶质的质量分数.
II、然后同学们又比较了各催化剂在室温下对50mL、6%的H2O2溶液分解反应的催化作用情况.
[实验记录]各催化剂对50mL、6%的H2O2溶液分解反应的催化作用情况(室温22℃)
| 催化剂及用量 | O2 平均产量 | 制氧所需时间 | 成本 | 反应情况 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均匀产生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均匀产生O2 |
[提出问题]同学们认为用FeCl3溶液作催化剂效果最好.但FeCl3溶液为何能催化分解H2O2?
[实验猜想]已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是________ 同学的猜想,理由是________.
同学们对余下的两个猜想,用实验进行了探究,请你仔细分析后填空:
[实验过程1]向盛有5mL、6% H2O2溶液的试管中加入少量的HCl溶液,并把带火星的木条伸入试管.
[实验现象1]无明显现象.对应结论:________.
[实验过程2]另向盛有5mL、6%的H2O2溶液的试管中加入少量的________,并再次把带火星的木条伸入试管.
[实验现象2]________.
对应结论:________.
[拓展研究]
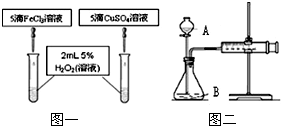
同学们还比较了FeCl3和CuSO4两种盐对H2O2分解的催化效果,他们分成甲、乙两组,分别设计了如图一、图二所示的实验并进行了实验.(设两种盐溶液的浓度等条件相同)

(1)指出仪器名称:A________ B________
(2)写出以FeCl3为催化剂的反应的化学方程式________.
(3)图一可通过观察________来定性比较得出结论.有同学提出将药品CuSO4改为CuCl2更为合理,其理由是________,你认为药品还可以作何改进?________.
(4)检查图二装置气密性的方法是:________(填“打开”或“关闭”)仪器A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察到活塞又回到了原位,则说明装置气密性________(填“良好”或“不好”).该组同学利用图二所示实验需测量的数据是________(填序号:A.一定时间内收集到的气体体积 B.收集一定体积的气体所需双氧水的质量).
研究小组还对溶液浓度、温度等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
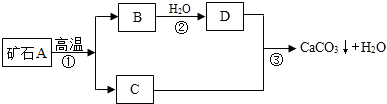
I:牙膏是人们生活中的必需品,在牙膏的生产中常添加一种摩擦剂.这种摩擦剂是由某种自然界中分布很广的矿石A,经过一系列加工而制得的极细小的轻质碳酸钙粉末,其生产过程如下:

试回答:
(1)写出 C、D两种物质的化学式 C______D______
(2)写出③反应的化学方程式______
(3)反应③制轻质碳酸钙粉末后,还要通过______(填操作)将其从反应后的混合物中分离出来.实验室进行该操作时主要用到的玻璃仪器有:烧杯、玻璃棒、______.
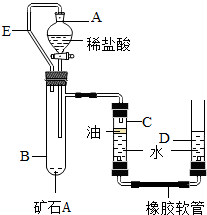
II、某兴趣小组为了测定本地所产矿石A的纯度,利用下图装置设计了以下实验方案:
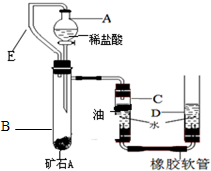 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验步骤】
①连接装置并检查装置气密性;
②在试管B中加入10克矿石A,分液漏斗中加入足量的稀盐酸,C、D管中加入一定量的水,C管的液面上加一 层油,并将分液漏斗A和试管B用长导管E连接起来.
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中B液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量并由此求出矿石A中碳酸钙的质量分数
【实验分析】
(1)小明同学认为在实验前要将矿石A 全磨成粉末状,你认为他的目的是:______;
(2)小洁同学认为该实验的设计中最经典的是连接仪器A和仪器B的橡胶管E,你认为如果没有橡胶管E,则会对实验结果产生何种影响?______
(3)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管,______,则气密性良好;
(4)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验:清判断并说明理由______.
(5)实验结束时同学们才发现由于粗心,小伟将植物油加到了D管的水面上,大家一致认为由于该粗心将会导致测得的矿石A中碳酸钙的质量分数产生误差,你认为该误差是______(填偏大或偏小).
(6)化学老师看了他们的实验设计后,对他们的设计方案和合作意识、探究精神都给予了很高的评价,并对他们进行启发:二氧化碳的质量可以根据质量守恒定律,测反应前后烧杯中剩余物质的质量之差来求得,于是他们又在烧杯中进行了如下的实验测定:
| 实验次数 项目 | 第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |
①当所取矿石A和稀盐酸的质量比______时,矿石A和稀盐酸恰好完全反应.
②矿石A中碳酸钙的质量分数是多少?
③所用稀盐酸的溶质质量分数是多少?
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
I、他们首先配制实验所需的50mL、6%的H2O2溶液.
[配制溶液]
现有一瓶新购置的双氧水,标签如图所示.
(1)若用这瓶双氧水来配置6%的医用双氧水1500g,需要这种双氧水的质量是多少克?
(2)另有一瓶5个月前购进的相同规格的双氧水,经检测,已缓慢分解放出了9.6g氧气,求现在剩余的该瓶溶液中溶质的质量分数.
II、然后同学们又比较了各催化剂在室温下对50mL、6%的H2O2溶液分解反应的催化作用情况.
[实验记录]各催化剂对50mL、6%的H2O2溶液分解反应的催化作用情况(室温22℃)
[实验分析]由表中数据及实验体验可以得出,MnO2 催化分解H2O2制氧气有两点不足,①开始反应速率过快,氧气产生后,发生装置内压强骤然增大,使用分液漏斗滴液往往受阻,收集氧气排水或排空气时稍微耽搁,就会有不少O2 逸失,到收集最后一瓶O2反应变慢,耗时太长.② .
[提出问题]同学们认为用FeCl3溶液作催化剂效果最好.但FeCl3溶液为何能催化分解H2O2?
[实验猜想]已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 同学的猜想,理由是 .
同学们对余下的两个猜想,用实验进行了探究,请你仔细分析后填空:
[实验过程1]向盛有5mL、6% H2O2溶液的试管中加入少量的HCl溶液,并把带火星的木条伸入试管.
[实验现象1]无明显现象.对应结论: .
[实验过程2]另向盛有5mL、6%的H2O2溶液的试管中加入少量的 ,并再次把带火星的木条伸入试管.
[实验现象2] .
对应结论: .
[拓展研究]
同学们还比较了FeCl3和CuSO4两种盐对H2O2分解的催化效果,他们分成甲、乙两组,分别设计了如图一、图二所示的实验并进行了实验.(设两种盐溶液的浓度等条件相同)

(1)指出仪器名称:A B
(2)写出以FeCl3为催化剂的反应的化学方程式 .
(3)图一可通过观察 来定性比较得出结论.有同学提出将药品CuSO4改为CuCl2更为合理,其理由是 ,你认为药品还可以作何改进? .
(4)检查图二装置气密性的方法是: (填“打开”或“关闭”)仪器A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察到活塞又回到了原位,则说明装置气密性 (填“良好”或“不好”).该组同学利用图二所示实验需测量的数据是 (填序号:A.一定时间内收集到的气体体积 B.收集一定体积的气体所需双氧水的质量).
研究小组还对溶液浓度、温度等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
[交流讨论]从上表中还能得出的结论是: .

I、他们首先配制实验所需的50mL、6%的H2O2溶液.
[配制溶液]
现有一瓶新购置的双氧水,标签如图所示.
(1)若用这瓶双氧水来配置6%的医用双氧水1500g,需要这种双氧水的质量是多少克?
(2)另有一瓶5个月前购进的相同规格的双氧水,经检测,已缓慢分解放出了9.6g氧气,求现在剩余的该瓶溶液中溶质的质量分数.
II、然后同学们又比较了各催化剂在室温下对50mL、6%的H2O2溶液分解反应的催化作用情况.
[实验记录]各催化剂对50mL、6%的H2O2溶液分解反应的催化作用情况(室温22℃)
| 催化剂及用量 | O2 平均产量 | 制氧所需时间 | 成本 | 反应情况 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均匀产生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均匀产生O2 |
[提出问题]同学们认为用FeCl3溶液作催化剂效果最好.但FeCl3溶液为何能催化分解H2O2?
[实验猜想]已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 同学的猜想,理由是 .
同学们对余下的两个猜想,用实验进行了探究,请你仔细分析后填空:
[实验过程1]向盛有5mL、6% H2O2溶液的试管中加入少量的HCl溶液,并把带火星的木条伸入试管.
[实验现象1]无明显现象.对应结论: .
[实验过程2]另向盛有5mL、6%的H2O2溶液的试管中加入少量的 ,并再次把带火星的木条伸入试管.
[实验现象2] .
对应结论: .
[拓展研究]
同学们还比较了FeCl3和CuSO4两种盐对H2O2分解的催化效果,他们分成甲、乙两组,分别设计了如图一、图二所示的实验并进行了实验.(设两种盐溶液的浓度等条件相同)

(1)指出仪器名称:A B
(2)写出以FeCl3为催化剂的反应的化学方程式 .
(3)图一可通过观察 来定性比较得出结论.有同学提出将药品CuSO4改为CuCl2更为合理,其理由是 ,你认为药品还可以作何改进? .
(4)检查图二装置气密性的方法是: (填“打开”或“关闭”)仪器A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察到活塞又回到了原位,则说明装置气密性 (填“良好”或“不好”).该组同学利用图二所示实验需测量的数据是 (填序号:A.一定时间内收集到的气体体积 B.收集一定体积的气体所需双氧水的质量).
研究小组还对溶液浓度、温度等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |

 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数. 在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.