题目内容
在某铁的样品中,可能含有Zn、Mg、Al、Cu等金属杂质中的2种,取5.6g样品跟足量稀硫酸反应,得到0.20gH2,则此铁的样品中不可能含有的金属杂质是( )
【答案】分析:根据一定量金属与足量酸完全反应时,产生氢气质量= ×金属质量,可计算产生0.2g氢气消耗铁的质量恰好为5.6g,所以其余两种杂质金属产生同样多氢气时消耗金属质量一种大于5.6g,一种小于5.6g.
×金属质量,可计算产生0.2g氢气消耗铁的质量恰好为5.6g,所以其余两种杂质金属产生同样多氢气时消耗金属质量一种大于5.6g,一种小于5.6g.
解答:解:得到0.2g氢气需要消耗金属铁的质量m,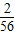 ×m=0.2g,则m=5.6g,所以铁样品中另两种金属为:产生0.2g氢气,需要金属的质量一种大于5.6g,另一种小于5.6g;
×m=0.2g,则m=5.6g,所以铁样品中另两种金属为:产生0.2g氢气,需要金属的质量一种大于5.6g,另一种小于5.6g;
根据一定量金属与足量酸完全反应时,产生氢气质量= ×金属质量,可计算得知,产生0.2g氢气,消耗铝、镁的质量为1.8克、2.4克,都小于5.6g而消耗锌的质量为6.5克,大于5.6g,铜不能与酸反应产生氢气;因此可判断样品中的两种金属杂质为金属铝、镁中的一种与金属锌、铜中一种所形成;
×金属质量,可计算得知,产生0.2g氢气,消耗铝、镁的质量为1.8克、2.4克,都小于5.6g而消耗锌的质量为6.5克,大于5.6g,铜不能与酸反应产生氢气;因此可判断样品中的两种金属杂质为金属铝、镁中的一种与金属锌、铜中一种所形成;
故选CD.
点评:相同质量的金属镁、铝、锌、铁完成反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌.
 ×金属质量,可计算产生0.2g氢气消耗铁的质量恰好为5.6g,所以其余两种杂质金属产生同样多氢气时消耗金属质量一种大于5.6g,一种小于5.6g.
×金属质量,可计算产生0.2g氢气消耗铁的质量恰好为5.6g,所以其余两种杂质金属产生同样多氢气时消耗金属质量一种大于5.6g,一种小于5.6g.解答:解:得到0.2g氢气需要消耗金属铁的质量m,
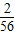 ×m=0.2g,则m=5.6g,所以铁样品中另两种金属为:产生0.2g氢气,需要金属的质量一种大于5.6g,另一种小于5.6g;
×m=0.2g,则m=5.6g,所以铁样品中另两种金属为:产生0.2g氢气,需要金属的质量一种大于5.6g,另一种小于5.6g;根据一定量金属与足量酸完全反应时,产生氢气质量=
 ×金属质量,可计算得知,产生0.2g氢气,消耗铝、镁的质量为1.8克、2.4克,都小于5.6g而消耗锌的质量为6.5克,大于5.6g,铜不能与酸反应产生氢气;因此可判断样品中的两种金属杂质为金属铝、镁中的一种与金属锌、铜中一种所形成;
×金属质量,可计算得知,产生0.2g氢气,消耗铝、镁的质量为1.8克、2.4克,都小于5.6g而消耗锌的质量为6.5克,大于5.6g,铜不能与酸反应产生氢气;因此可判断样品中的两种金属杂质为金属铝、镁中的一种与金属锌、铜中一种所形成;故选CD.
点评:相同质量的金属镁、铝、锌、铁完成反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在某铁的样品中,可能含有Zn、Mg、Al、Cu等金属杂质中的2种,取5.6g样品跟足量稀硫酸反应,得到0.20gH2,则此铁的样品中不可能含有的金属杂质是( )
| A、Cu和Mg | B、Zn和Al | C、Mg和Al | D、Zn和Cu |