��Ŀ����
����Ŀ����ͼ������������������ӡ�øߵ�Fe3O4�۵IJ��ֹ������̼�ͼ�� 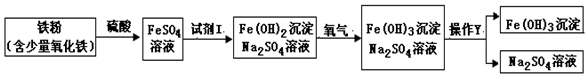
���Լ�I������Ϊ������YΪ���ˣ������ʵ���ҽ��У����õ��IJ����������֣����˺���Һ���л��ǣ�����������ã�����ܲ����������𣬸ò��������� ��
������������Ӧ�Ļ�ѧ����ʽΪ����������������Ӧ�Ļ�ѧ����ʽ��
�����ۣ����������������м������ᣬ�����������������ᷢ����Ӧ�⣬һ��������������Ӧ�����������жϵ������� ��
������������ת������������ķ�ӦΪ��4Fe��OH��2+O2+xH2O�T4Fe��OH��3 �� ����ƽ��xΪ ��
�����Fe��OH��3����һ��������ΪFe3O4 �� ���ȡ��ij�����ۣ�����������������Ʒ����ʵ����ģ�⣬������Ʒ����Ԫ��16.8g�����õ�Fe3O4mol��
���𰸡��������ƻ��ռ������Һ��������ֽ�����أ�Fe+H2SO4=FeSO4+H2����Fe2O3+3H2SO4=Fe2��SO4��3+3H2O����������Ӧ���ɵ���������������ȴ���ɶ�����������һ����������Ӧ���ڣ�2��0.1��
���������⣺���Լ�I�Ǻ�����������Ӧ���������������ģ�����Ӧ��������������Һ������Ϊ �������ƻ��ռ����YΪ���ˣ��ڹ��˲��������õ��IJ�������Ϊ�ձ�����������©�������� ���֣����˺���Һ���л��ǣ�����������ã�����ܲ����������𣬸ò��������� Һ�峬������ֽ�����أ�������������Ӧ����������������������Ӧ�Ļ�ѧ����ʽΪ Fe+H2SO4=FeSO4+H2������������������Ӧ������������ˮ����Ӧ�Ļ�ѧ����ʽ Fe2O3+3H2SO4=Fe2��SO4��3+3H2O�� �����ۣ����������������м������ᣬ�����������������ᷢ����Ӧ�⣬һ��������������Ӧ�����������жϵ������Ǹ�������Ӧ���ɵ���������������ȴ���ɶ�����������һ����������Ӧ���ڣ�������������ת������������ķ�ӦΪ��4Fe��OH��2+O2+xH2O�T4Fe��OH��3 �� ������ԭ�ӻ�����ԭ�Ӹ������䣬�����xΪ 2�������Fe��OH��3����һ��������ΪFe3O4 �� ���ȡ��ij�����ۣ�����������������Ʒ����ʵ����ģ�⣬������Ʒ����Ԫ��16.8g��
�����յõ������������������ʵ���Ϊx
������Ԫ���غ�ɵù�ϵʽΪ
3Fe���������� | Fe3O4 |
168g | 1mol |
16.8g | x |
![]() =
= ![]()
x=0.1mol
�����õ�Fe3O4 0.1mol��
���Դ��ǣ����������ƻ��ռ������Һ��������ֽ�����أ���Fe+H2SO4=FeSO4+H2����
Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��
��������Ӧ���ɵ���������������ȴ���ɶ�����������һ����������Ӧ���ڣ���2����0.1��
�����㾫�������չ��˲�����ע������ͽ������ϵ�ѡ�������ǽ����ĸ�������Ҫ֪�����˲���ע�������һ���������͡������������˺���Һ��Ȼ���ǵĿ���ԭ����:�ٳн���Һ���ձ����ɾ����㵹Һ��ʱҺ�������ֽ��Ե����ֽ���𣻺�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ�������������������

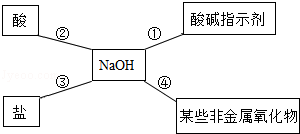
 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�