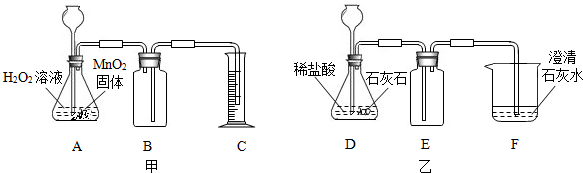
题目内容
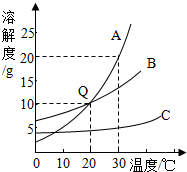 如图为A、B、C三种固体物质溶解度曲线.
如图为A、B、C三种固体物质溶解度曲线.(1)当温度为
(2)若将C物质从溶液中结晶析出,宜采用的方法是
(3)20℃时,向盛有50g水的烧杯中加入10g固体A,充分溶解后得到的溶液①,将上述混合物继续升温至30℃,得到溶液②.有关溶液①与溶液②的说法正确的是
A、溶液①和溶液②中溶剂的质量相等
B、溶液①与溶液②中溶质的溶解度相同
C、溶液①是饱和溶液,溶液②是不饱和溶液
D、溶液①与溶液②中溶质与溶剂的质量比都是1:5
E、溶液①中溶质质量分数小于溶液②中溶质质量分数.
考点:固体溶解度曲线及其作用,过滤的原理、方法及其应用,结晶的原理、方法及其应用
专题:溶液、浊液与溶解度
分析:(1)根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
(2)从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶;
过滤可以把不溶于水的物质从溶液中分离出来;
(3)根据物质的溶解度曲线可以判断相关方面的问题.
(2)从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶;
过滤可以把不溶于水的物质从溶液中分离出来;
(3)根据物质的溶解度曲线可以判断相关方面的问题.
解答:解:(1)当温度为20℃时,A和B的溶解度相等.
故填:20;
(2)C的溶解度受温度变化影响较小,若将C物质从溶液中结晶析出,宜采用的方法是蒸发结晶,将析出的C物质于液体分离采用的方法是过滤.
故填:蒸发结晶;过滤.
(3)20℃时,A的溶解度是10g,向盛有50g水的烧杯中加入10g固体A,充分溶解后得到的溶液①,此时只有5gA溶解;
将上述混合物继续升温至30℃时,得到溶液②,此时A的溶解度是20g,A全部溶解;
A、溶液①和溶液②中溶剂的质量相等,都是50g,该选项说法正确;
B、溶液①与溶液②中溶质的溶解度不相同,该选项说法不正确;
C、溶液①是饱和溶液,溶液②也是饱和溶液,该选项说法不正确;
D、溶液①与溶液②中溶质与溶剂的质量比分别是1:10和1:5,该选项说法不正确;
E、溶液①中溶质质量分数为:
×100%≈9.1%,
溶液②中溶质质量分数为:
×100%≈16.7%,该选项说法正确.
故填:AE.
故填:20;
(2)C的溶解度受温度变化影响较小,若将C物质从溶液中结晶析出,宜采用的方法是蒸发结晶,将析出的C物质于液体分离采用的方法是过滤.
故填:蒸发结晶;过滤.
(3)20℃时,A的溶解度是10g,向盛有50g水的烧杯中加入10g固体A,充分溶解后得到的溶液①,此时只有5gA溶解;
将上述混合物继续升温至30℃时,得到溶液②,此时A的溶解度是20g,A全部溶解;
A、溶液①和溶液②中溶剂的质量相等,都是50g,该选项说法正确;
B、溶液①与溶液②中溶质的溶解度不相同,该选项说法不正确;
C、溶液①是饱和溶液,溶液②也是饱和溶液,该选项说法不正确;
D、溶液①与溶液②中溶质与溶剂的质量比分别是1:10和1:5,该选项说法不正确;
E、溶液①中溶质质量分数为:
| 5g |
| 55g |
溶液②中溶质质量分数为:
| 10g |
| 60g |
故填:AE.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列事实表明分子间有间隔的是( )
| A、炒菜时在远处能闻到香味 |
| B、红墨水滴到水中扩散 |
| C、食盐是一种白色固体 |
| D、氧气可以压缩到蓝色钢瓶中保存 |
下列说法错误的是( )
| A、木炭在氧气中剧烈燃烧,生成黑色固体 |
| B、硫在空气中燃烧,生成有刺激性气味的气体 |
| C、铁丝在氧气中燃烧时,火星四射 |
| D、红磷在空气中燃烧时,产生大量的白烟 |