题目内容
电石是一种重要的化工原料,极易与水反应:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)将电石长期露置于空气中,会发生下列变化:电石(CaC2)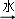 灰浆→残渣.残渣中主要成分是Ca(OH)2和 (写名称).
灰浆→残渣.残渣中主要成分是Ca(OH)2和 (写名称).
(2)工业上利用电石制备某化工原料的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

①向CaCl2溶液中通入NH3、CO2两种气体,生成CaCO3的化学方程式为 .
②流程中溶液A可循环使用,溶液A中的主要成分的化学式是 .
| (1)根据氢氧化钙露置在空气中,会与空气中的二氧化碳反应生成碳酸钙进行解答;(2)①由流程图找出反应物和生成物,正确书写化学方程式;②根据①的解答回答 | |
| 解答: | 解:(1)因为电石与水反应生成氢氧化钙,其露置在空气中,会与空气中的二氧化碳反应生成碳酸钙,故残渣中主要成分是Ca(OH)2和CaCO3; (2)①由流程图可以看出,反应物为氨气和二氧化碳和氯化钙和水,生成物为碳酸钙和氯化铵,用观察法配平,碳酸钙后面标上沉淀符号,其反应的化学方程式为:CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl; ②由①中的化学方程式可以得知,A溶液的化学式为:NH4Cl. 故答案:(1)碳酸钙 (2)①CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl ②NH4Cl |

练习册系列答案
相关题目





 灰浆→残渣.残渣中主要成分是Ca(OH)2和 (写名称).
灰浆→残渣.残渣中主要成分是Ca(OH)2和 (写名称).