题目内容
100g硫酸铜溶液中放入5.6g铁粉恰好完全反应。试计算
(1)生成铜的质量;
(2)硫酸铜溶液中溶质的质量分数
(3)反应后所得溶液中溶质的质量分数(精确到0.1%)
(1)生成铜的质量;
(2)硫酸铜溶液中溶质的质量分数
(3)反应后所得溶液中溶质的质量分数(精确到0.1%)
(1)6.4g……2分 (2)16%……2分 (3)15.3%……2分
(1)设生成铜的质量为x,生成FeSO4的质量为y,参加反应的硫酸铜的质量为z.
Fe+CuSO4═FeSO4+Cu
56 160 152 64
5.6g z y x
56:5.6g="64:x" =152:y=160:z 解得:x=6.4g,y=15.2g,z=16g;
(2)根据质量分数公式,硫酸铜溶液中溶质的质量分数为:16 g /100g×100%=16%;
(3)根据质量守恒定律,反应后所得溶液的质量为:100g+5.6g-6.4g=99.2g,
则反应后所得溶液的溶质质量分数为: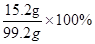 =15.3%.
=15.3%.
答:(1)生成铜的质量为6.4g;(2)硫酸铜溶液中溶质的质量分数16%;(3)反应后所得溶液的溶质质量分数为15.3%.
Fe+CuSO4═FeSO4+Cu
56 160 152 64
5.6g z y x
56:5.6g="64:x" =152:y=160:z 解得:x=6.4g,y=15.2g,z=16g;
(2)根据质量分数公式,硫酸铜溶液中溶质的质量分数为:16 g /100g×100%=16%;
(3)根据质量守恒定律,反应后所得溶液的质量为:100g+5.6g-6.4g=99.2g,
则反应后所得溶液的溶质质量分数为:
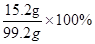 =15.3%.
=15.3%.答:(1)生成铜的质量为6.4g;(2)硫酸铜溶液中溶质的质量分数16%;(3)反应后所得溶液的溶质质量分数为15.3%.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目




