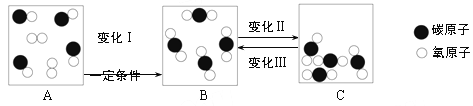
题目内容
【题目】人类的生产和生活都离不开金属。
Ⅰ.金属元素在自然界中分布很广,在地壳中主要以矿物形式存在。下列矿石的主要成分不属于氧化物的是 (填序号)。

Ⅱ.铁是应用最广泛的金属。
(1)下图是工业炼铁示意图。
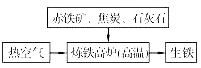
其中,焦炭的作用是燃烧提供能量和 ;
写出有铁生成的化学方程式 。
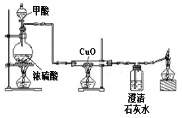
(2)某兴趣小组在实验室中模拟炼铁的化学原理,用一氧化碳还原纯净的氧化铁粉末,实验装置如图。
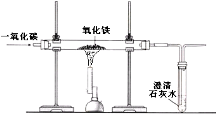
①实验中玻璃管里固体粉末的颜色变化是 ,澄清的石灰水中发生反应的化学方程式是 。
②该装置有何不妥? 。
(3)该化学兴趣小组的同学利用改正后的装置进行探究用500g含氧化铁质量分数为70%的赤铁矿,可以炼出含杂质4%的生铁多少克?
【答案】I:B ;II:(1)产生还原剂一氧化碳;3 CO +Fe2O3高温2 Fe + 3 CO2;(2)红棕色粉末逐渐变为黑色;CO2 + Ca(OH)2 = CaCO3↓+ H2O(3)没有进行尾气处理;
(3)解 :设可以炼出含杂质4%的生铁的质量为X
赤铁矿中氧化铁的质量为:500g×70%=350g
设350t氧化铁能生成生铁的质量为x
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
350g x×(1-4%)
160:350g=112:x×(1-4%)
x=255.2g
答:可以炼出含杂质4%的生铁的质量为255.2克
【解析】
试题分析:I:氧化物是由两种元素组成的,其中一种为氧元素的化合物,氧化铁和氧化铝为氧化物,故选B;II(1)焦炭的作用是燃烧时提供能量,同时产生还原剂一氧化碳;有铁产生的反应是高炉炼铁,化学方程式为:3 CO +Fe2O3高温2 Fe + 3 CO2,(2)玻璃管中的红棕色粉末会逐渐变为黑色,澄清的石灰水变浑浊,发生反应的化学方程式为:CO2 + Ca(OH)2 = CaCO3↓+ H2O;该装置没有将多余的一氧化碳进行处理,扩散到空气中会污染环境,因为一氧化碳有毒。(3)首先计算出氧化铁的质量,然后利用化学方程式进行计算即可。

【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为________________________________;
【查阅资料】
碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式为 |
(2)将上述反应后的混合液过滤,取滤液加入 ; | 证明猜想Ⅱ成立。 |