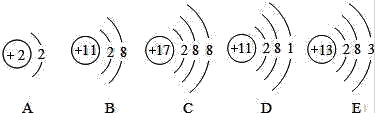
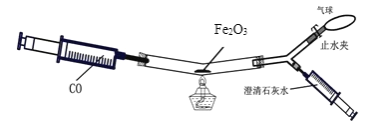
题目内容
【题目】能源的煤气化和液化流程示意图如下图所示,请结合图像回答问题:
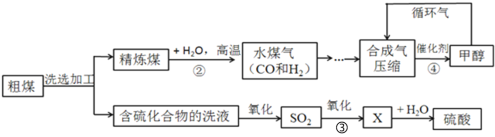
(1)精炼煤中主要成分是碳,步骤②中发生反应的化学方程式为_________________。
(2)步骤③中,SO2进一步氧化得到X,X为硫的另一种氧化物,其中硫元素的化合价为+6价,X的化学式为________。
(3)经过进一步净化,含较多杂质的水煤气转化为合成气(CO和H2的混合气体),步骤④中生成的甲醇(CH3OH)是一种重要的化工原料,该反应的化学方程式为______________
(4)循环气的主要成分是__________和少量未完全分离出去的甲醇。
(5)从“绿色化学”的角度分析,“煤的气化和液化”流程的优点:__________________。
【答案】C+H2O![]() CO +H2 SO3 CO+2H2
CO +H2 SO3 CO+2H2 CH3OH 一氧化碳 几乎将原料全部转化成了产品,实现了“零排放”,减少了对环境的污染
CH3OH 一氧化碳 几乎将原料全部转化成了产品,实现了“零排放”,减少了对环境的污染
【解析】
(1)精炼煤中主要成分是碳,步骤②中发生的反应是碳与水在高温下生成一氧化碳和氢气,其化学方程式为C+H2O![]() CO +H2。
CO +H2。
(2)步骤③中,SO2进一步氧化得到X,X为硫的另一种氧化物,硫元素的化合价为+6价,根据化合价书写化学式可知,硫元素显+6价,氧元素显-2价,在氧化物中氧元素写在化学式的后面,所以X的化学式为SO3。
(3)经过进一步净化,含较多杂质的水煤气转化为合成气(CO和H2的混合气体),步骤④中生成的甲醇(CH3OH),由图知,合成气在催化剂的作用生成甲醇,所以该反应的化学方程式为CO+2H2 CH3OH。
CH3OH。
(4)根据生产水煤气的化学方程式可知,碳与水生成的一氧化碳与氢气的化学计量数之比为1:1,而在生产甲醇的反应中一氧化碳与氢气的化学计量数之比为1:2,所以一氧化碳有剩余,循环气的主要成分是一氧化碳和少量未完全分离出去的甲醇。
(5)从“绿色化学”的角度分析,“煤的气化和液化”流程的优点:几乎将原料全部转化成了产品,实现了“零排放”,减少了对环境的污染。

 小题狂做系列答案
小题狂做系列答案【题目】按图进行下列实验(U型管内为植物油,初始液面相平,装置气密性良好;滴加的液体适量且等体积,试管中固体等质量且表面积相同),U型管内现象描述不正确的是
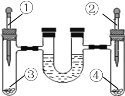
选项 | 试剂① | 试剂② | 试剂③ | 试剂④ | 初始现象 | 最终现象 |
A | 6%双氧水 | 6%双氧水 | MnO2固体 | 无 | 左降右升 | 左右相平 |
B | 10%稀硫酸 | 10%稀硫酸 | 锌片(足量) | 镁带(足量) | 左升右降 | 左右相平 |
C | 食盐水 | 蒸馏水 | 铁丝 | 铁丝 | 左降右升 | 左低右高 |
D | 10%稀盐酸 | 10%稀盐酸 | NaCl粉末 | 石灰石 | 左升右降 | 左高右低 |
A.AB.BC.CD.D