题目内容
【题目】某学习小组做镁在空气中燃烧实验时,发现生成物中有黑色固体,针对这一现象及该反应的应用,他们开展了如下探究,请仔细阅读并完成下列探究报告。
(探究目的)探究黑色固体是镁与空气中什么物质反应产生的。
(分析猜想)分析空气中各种成分,寻找猜想依据:
空气成分一:氧气;空气成分二:氮气;空气成分三:水蒸气;空气成分四:二氧化碳。
(实验一)镁与氧气的反应
(一)制取氧气并探究氯酸钾和二氧化锰制氧气反应物与催化剂的最佳质量比。
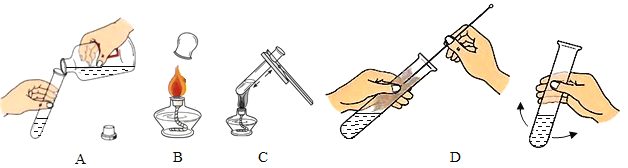
实验中采用如图1、2所示装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中。在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200mL氧气所消耗的时间。实验数据如表:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量/g | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200mL氧气时间/秒 | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
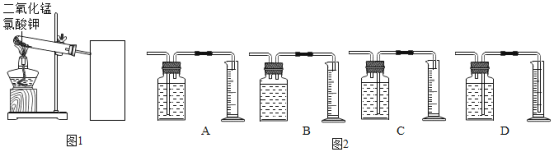
(1)实验开始前先_____;
(2)为了完成本实验,方框内应选择图2气体收集装置中的_____(填字母);
(3)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_____;
(4)催化剂能影响化学反应速度,温度、反应物的浓度(或质量分数)、反应物接触面积等也会影响化学反应速度。分析上表数据,结合影响化学反应速度的因素分析当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_______。
(二)燃烧镁带
将镁带打磨,点燃,伸入盛满氧气的集气瓶中,产生大量白烟,生成白色固体。
实验结论:镁与氧气反应生成白色的氧化镁。
(实验二)镁与氮气的反应
(一)获取氮气:
方法1:工业上把空气液化,然后蒸发,先蒸发出来的气体就是氮气;
方法2:实验室将氨气通过红热的氧化铜,可制得纯净的氮气和铜。属于化学变化的是_____(填“方法1”或“方法2”)
(二)燃烧镁带
打磨镁带光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁,其中氮元素的化合价为﹣3,则该反应的符号表达式为_____
(实验三)镁与水蒸气的反应
实验装置如下图所示:
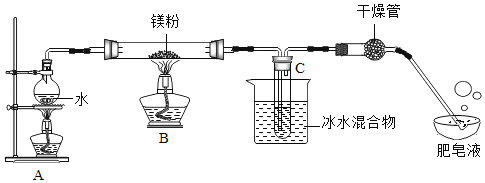
(1)装置A中放入几粒沸石或碎瓷片的目的是______;
(2)实验开始时,应先点燃A处酒精灯,等观察到水沸腾后,再点燃B处酒精灯,这样做的目的是_____;
(3)生成的气体通入肥皂液中,用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中,说明生成的气体是____;
实验结论:镁粉能和水蒸气反应,但装置B中并没有产生黑色固体
(探究结论)根据以上信息,可以推理得出镁在空气中燃烧产生的黑色固体是镁与空气中的_____反应产生的。
【答案】检查装置气密性 C 1:3 二氧化锰与氯酸钾的接触面积小 方法2 Mg+N2![]() Mg3N2 防止暴沸 排尽空气,防止镁和氧气及氮气反应(只要答到前半句就对) H2 CO2
Mg3N2 防止暴沸 排尽空气,防止镁和氧气及氮气反应(只要答到前半句就对) H2 CO2
【解析】
实验一:
(一)(1)实验开始前先检查装置气密性;
(2)为了完成本实验,正确的收集装置为C,其中AB不能将水排出收集气体,D测量所排出水的体积不准确;
(3)分析上述数据,二氧化锰与氯酸钾的最佳质量比为1:3时,生成200mL氧气时间最短,故二氧化锰与氯酸钾的最佳质量比为1:3;
(4)反应物接触面积等会影响化学反应速度,分析上表数据,当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是二氧化锰与氯酸钾的接触面积小。
实验二:
(一)方法1过程没有新物质生成,属于物理变化;方法2过程有新物质铜和氮气生成,属于化学变化;故属于化学变化的是方法2;
(二)实验结论:
镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁,其中氮元素的化合价为﹣3,可知氮化镁化学式为![]() ,则该反应的符号表达式为
,则该反应的符号表达式为![]() 。
。
实验三:
(1)装置A中放入几粒沸石或碎瓷片的目的是防止暴沸;
(2)实验开始时,应先点燃A处酒精灯,等观察到水沸腾后,再点燃B处酒精灯,这样做的目的是排尽空气,防止镁和氧气及氮气反应;
(3)生成的气体通入肥皂液中,用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中,说明生成的气体是氢气;
探究结论:
根据以上信息,可以推理得出镁在空气中燃烧产生的黑色固体是镁与空气中的二氧化碳反应产生的。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校化学兴趣小组学习了气体的制取和收集后,对相关知识进行总结,并完成下面题目:
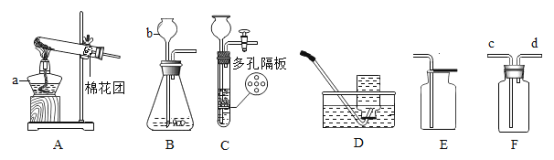
(1)写出下列仪器名称:a____,b___。
(2)实验室若用AD组合装置制取氧气,反应的符号表达式为____;实验结束时先熄灭撤酒精灯火焰,发现导管中有水开始倒吸了,应该采取什么措施补救:____;若用E装置收集氧气则验满方法是____。
(3)实验室制取二氧化碳时,用C装置代替B装置在操作方面的优点是____;若在装置F内装一些澄清石灰水来检验,则气体应从____端通入(填c或d),反应的符号表达式是____。
(4)已知:实验室可以用加热氯化铵和氢氧化钙的混合物制取氨气。氨气的密度比空气的小,有毒,极易溶于水,溶于水后形成氨水。某同学用如图F装置来收集氨气,气体从____端进(选c或d)。
(5)在查阅资料时,某小组的同学们得知氧化铁也可以作为过氧化氢分解制取氧气的催化剂,他们联想到MnO2可作为H2O2分解的催化剂,那么,氧化铁和二氧化锰这两种物质哪一种更适合呢?请你一起参与探究,完成下列问题。
(分析与讨论)探究二氧化锰、氧化铁对过氧化氢分解速率的影响时,他们在控制变量的问题上提出了不同的观点,你认为不正确的是___。
A 过氧化氢溶液中溶质的质量分数一定相同 B 催化剂的质量一定相同
C 反应前过氧化氢溶液的温度一定相同 D 反应容器的容积一定相同
(实验验证)研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究。下表选取了部分实验数据:用足量不同浓度的H2O2溶液制取相同体积O2所需的时间。
30%双氧水 | 15%双氧水 | 5%双氧水 | |
加入agMnO2 | 0.2 | 0.8 | 2.0 |
加入agFe2O3 | 7.0 | 9.0 | 16.0 |
(实验结论)从上表中能得出哪些结论?(写出一点即可)_____。