题目内容
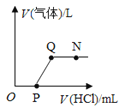
【题目】7.0g含杂质的铁粉样品与足量稀硫酸反应,产生氢气的物质的量与时间关系如图甲所示(杂质不与酸.碱.盐发生反应)。

计算样品中所含铁的物质的量(根据化学方程式列式计算)。(7)样品中铁的质量分数为(8)。
另外a g该铁粉样品与足量硫酸铜溶液反应,产生铜的物质的量与时间关系如图乙所示。则a为(9)g。
【答案】①(7)样品中铁的物质的量为0.1mol(8)80% ②7.0g
【解析】试题分析:①根据题意可知:生成氢气的物质的量为0.1mol。可根据化学方程式中铁与氢气的关系进行求解。再进一步计算样品中铁的质量分数。
②根据题意可知:生成铜的物质的量为0.1mol。可根据化学方程式中铁与铜的关系进行求解出纯铁的物质的量。再进一步结合样品中铁的质量分数计算样品的质量。具体过程如下:
①解:设样品中铁的物质的量为xmol
Fe+ H2SO4→FeSO4+H2↑
1 1
xmol 0.1mol
1:1=xmol:0.1mol
x=0.1
样品中铁的质量分数为:![]() ×100%=80%
×100%=80%
②解:设样品中铁的物质的量为ymol
Fe+ CuSO4→FeSO4+Cu
1 1
ymol 0.1mol
1:1=ymol:0.1mol
y=0.1
样品中铁的质量分数为:![]() = 7.0g
= 7.0g

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目