��Ŀ����
����Ŀ��ijͬѧ����������ɽ����о�����ȡ������Ʒ40g����500gϡ�����5�μ�����Ʒ�У����ʵ�����ݼ��±����������е����ʲ�����ˮ��Ҳ����ϡ���ᷴӦ��
ʵ����� | ����ϡ���������/g | ʣ����������/g |
��1�� | 100 | 28.8 |
��2�� | 100 | 17.6 |
��3�� | 100 | 6.4 |
��4�� | 100 | m |
��5�� | 100 | 1.2 |
��1����4��ʣ����������m=g��
��2����������Ʒ��������������Ϊ ��
��3����������ϡ�������������������
���𰸡�
��1��1.2
��2��97%
��3���⣺��ÿ100g������Һ����������Ϊx����Ӧ������������Ϊ��40g��28.8g=11.2g��
Fe+ | H2SO4=FeSO4+H2�� |
56 | 98 |
11.2g | x |
![]() ��ã�x=19.6g
��ã�x=19.6g
����ϡ������������������ǣ� ![]() =19.6%
=19.6%
���������⣺��1���ɱ��е����ݶԱȷ�����֪����4��ʣ����������m=1.2g����2����������Ʒ��������������Ϊ�� ![]() =97%��
=97%��
�����㾫����������Ŀ����֪���������ø��ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ո����ʼ�������=ϵ������Է�������֮�ȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��2014��3��22���ǵڶ�ʮ���조����ˮ�ա��� ȥ��������ǡ�ˮ��������ˮ����������������������أ������°桶��������ˮ����������ȥ��7��1����ǿ��ʵʩ���±����ҹ��䲼����������ˮˮ�ʱ��IJ������ݣ�
��Ŀ | �� |
�й�ָ�� | ����ζ������� |
��ѧָ�� | pH 6.5��8.5��ͭ��1.0mgL��1 �� �����1.0mgL��1 �� �����ȡ�0.3mgL��1�� |
��1���й�ָ����ֵ�������ˮ�����ʣ����������ѧ����������ѧָ���е� pH=8ʱ����������ˮ��������ԡ��������ԡ������ԡ�����
��2����ͼ1��ʾij������ˮ�ľ������̣���ش��������⣺ 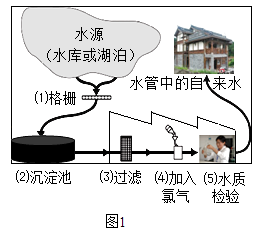
��Ȼˮ�к����������ʣ����������������������˺�����ȷ������������о����̶���ߵķ����� ��
��3��Ӳˮ����������������ܶ��鷳�������п���������Ӳˮ����ˮ��
��4������ˮ����������Ŀǰ���õ�Һ�����⣬�������Ȱ���NH2Cl����������O3���ȣ�O3����Ԫ�صĻ��ϼ��� ��
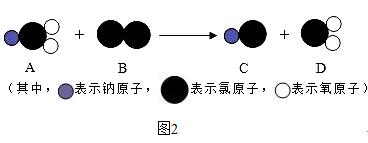
��5��ClO2����һ������ˮ����������������������Cl2��������ˮ����������ȡClO2�ķ�Ӧ����ʾ��ͼ��ͼ2���÷�Ӧ�Ļ�ѧ����ʽ��