题目内容
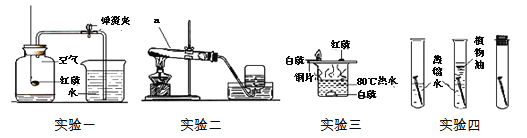
【题目】化学实验室制取气体的部分仪器或装置如图所示,请回答下列问题。
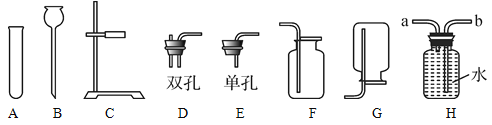
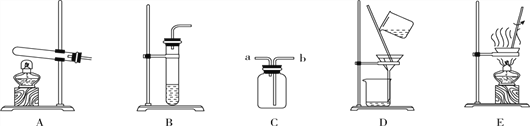
(1)仪器C的名称:________。
(2)若用锌粒与稀硫酸反应制取氢气,发生装置中已经选择了A、C、D,则还要选择以上仪器中的________(写名称);若用装置H收集氢气,氢气应从________(填“a”或“b”)端通入。
(3)某同学用上述(2)中的方法制取氢气,结果未收集到氢气,请你帮他分析可能的原因是_____________。(写一条即可)
【答案】 铁架台 长颈漏斗 a 装置漏气或长颈漏斗的下端管口未伸入液面以下
【解析】(1)仪器C的名称:铁架台;(2)若用锌粒与稀硫酸反应制取氢气,属于固液不加热型,发生装置中已经选择了A、C、D,则还要选择以上仪器中的长颈漏斗;氢气难溶于水,密度比水小,若用装置H收集氢气,氢气应从a端通入;(3)某同学用上述(2)中的方法制取氢气,结果未收集到氢气,可能的原因是:装置漏气或长颈漏斗的下端管口未伸入液面以下。

【题目】某实验室用含硫酸铜和盐酸的混合液与混入了锌粉的铜粉(以下简称铜锌粉)反应来测定混合液中盐酸的质量分数和铜锌粉中锌的含量。操作如下:取200 g混合液于实验容器中,分五次加入铜锌粉,边加边搅拌,以保证盐酸和硫酸铜同时与锌充分反应。实验测得的相关数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入铜锌粉的累计质量/ g | 9 | 18 | 27 | 36 | 40 |
产生氢气的累计质量/ g | 0.1 | 0.2 | m | 0.4 | 0.4 |
容器中剩余固体的质量/ g | 5.71 | 11.42 | 17.13 | 22.84 | 26.84 |
(1)表中m的值为_____________。
(2)第四次加入铜锌粉并充分反应后,溶液中所含溶质的化学式为_____________。
(3)计算原混合液中盐酸的质量分数是多少_____________?(写出计算过程,结果精确到0.1%)
(4)通过计算可知,每9 g铜锌粉中含有_______________g锌粉。