题目内容
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题. 研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.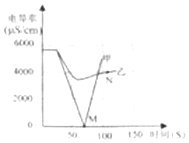
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示. ①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈色;
③通过对甲曲线的分析,下列说法错误的是(填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点时离子浓度几乎为零
C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示. ①通过对乙曲线的分析,下列说法错误的是(填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是(填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度(填“增大”或“减小”).
(3)拓展:①请根据示例仿写离子方程式. 示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
【答案】
(1)Ba(OH)2+H2SO4=BaSO4↓+2H2O;无;C
(2)A;Na+、OH﹣、SO42﹣;减小
(3)Ba2++SO42﹣=BaSO4↓;先减小后增大
【解析】解:(1)①Ba(OH)2与H2SO4反应生成硫酸钡沉淀和水,反应的化学方程式为Ba(OH)2+H2SO4=BaSO4↓+2H2O,故填:Ba(OH)2+H2SO4=BaSO4↓+2H2O.②甲曲线M点时二者恰好完全反应,溶液呈中性,酚酞为无色,故混合液体呈无色,故填:无;③A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4 , 正确; B.M点时二者恰好完全反应,离子浓度几乎为零,正确;
C.M点后溶液电导率逐渐增大,不仅由于溶液中H+在逐渐增大,硫酸根离子也在增大,错误;
故填:C;(2)①A.开始至完全反应过程中,电导率减小,反应生成的氢氧化钠呈碱性,溶液仍为红色,错误;
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子,正确;
C.整个实验过程中,溶液中Na+数目一直增大,正确;
故填:A;②N点时,溶液中含有氢氧化钠和过量的硫酸钠,故含有的离子是钠离子、氢氧根离子和硫酸根离子,故填:Na+、OH﹣、SO42﹣ . ③溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度减小,故填:减小.(3)①BaCl2+Na2SO4=BaSO4↓+2NaCl反应的实质是钡离子和硫酸根离子结合产生硫酸钡沉淀,其离子方程式为Ba2++SO42﹣=BaSO4↓,故填:Ba2++SO42﹣=BaSO4↓.②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊,此过程中钙离子浓度逐渐减小,浑浊逐渐消失的过程中钙离子的浓度逐渐增大,故填:先减小后增大.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案