题目内容
呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂。下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中。
【查阅资料】过氧化钠在常温下能与水反应生成NaOH和O2,与CO2反应产生Na2CO3(Na2CO3溶液呈碱性)和O2。
【设计实验】兴趣小组同学通过下图装置探究CO2与Na2O2的反应。实验过程如下:
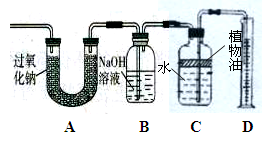
(1)测定过氧化钠样品中过氧化钠的纯度。
用上图装置通过测定产生的氧气的体积,从而测定过氧化钠样品中过氧化钠的纯度,则装置中B瓶的作用是 ,若没有B瓶,则测出的过氧化钠在样品中的质量分数 (填“偏大”、“偏小”或“不变”)。
(2)检验U型管中反应后剩余固体的成分。
A.[对固体的猜想]
猜想Ⅰ.全部是Na2CO3; 猜想Ⅱ. 。
B.【实验和推断】
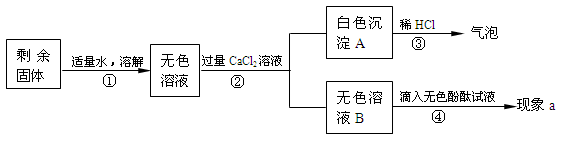
(1)步骤②所需要的玻璃仪器有:烧杯、玻璃棒和 ,玻璃棒在步骤①中的作用是 。
(2)步骤③说明白色固体A是 (填化学式),产生白色沉淀的化学方程式是 。
(3)若现象a没有明显变化,则猜想 成立。猜想Ⅱ成立,现象a是 。
【反思与拓展】①Na2O2与CO2反应的化学方程式是 。
②过氧化钠作潜水艇的供氧剂的优点是 (答一点)。
【查阅资料】过氧化钠在常温下能与水反应生成NaOH和O2,与CO2反应产生Na2CO3(Na2CO3溶液呈碱性)和O2。
【设计实验】兴趣小组同学通过下图装置探究CO2与Na2O2的反应。实验过程如下:

(1)测定过氧化钠样品中过氧化钠的纯度。
用上图装置通过测定产生的氧气的体积,从而测定过氧化钠样品中过氧化钠的纯度,则装置中B瓶的作用是 ,若没有B瓶,则测出的过氧化钠在样品中的质量分数 (填“偏大”、“偏小”或“不变”)。
(2)检验U型管中反应后剩余固体的成分。
A.[对固体的猜想]
猜想Ⅰ.全部是Na2CO3; 猜想Ⅱ. 。
B.【实验和推断】

(1)步骤②所需要的玻璃仪器有:烧杯、玻璃棒和 ,玻璃棒在步骤①中的作用是 。
(2)步骤③说明白色固体A是 (填化学式),产生白色沉淀的化学方程式是 。
(3)若现象a没有明显变化,则猜想 成立。猜想Ⅱ成立,现象a是 。
【反思与拓展】①Na2O2与CO2反应的化学方程式是 。
②过氧化钠作潜水艇的供氧剂的优点是 (答一点)。
(1)除去未反应的CO2 偏大 (2)A猜想:是Na2CO3和Na2O2的混合物 B(1)漏斗 加速溶解 (2)Na2CO3 Na2CO3+CaCl2==CaCO3↓+2NaCl (3)Ⅰ 无色酚酞试液变红色 【反思与拓展】①2Na2O2+2CO2="2" Na2CO3+O2 ②在常温下反应(或能吸收人呼出的CO2等)
分析:【设计实验】(1)参与反应的二氧化碳会影响反应的结果,故应该除去;
(2)A、根据反应的进行可以对固体的成分作出推测;
B.【实验和推断】(1)根据过滤操作来选择装置;
(2)能够和氯化钙反应生成白色沉淀的是碳酸钠;
(3)加入酚酞若仍然呈现无色说明没有过氧化钠,若变为红色则说明存在着过氧化钠;
【反思与拓展】①根据提示可以写反应的化学方程式;
②根据反应的产物和反应条件来进行分析.
解答:解:【设计实验】(1)由于参与反应的二氧化碳会影响反应的结果,如果不除去则会使量筒中水的体积偏大,所以应该除去;
(2)A、根据反应可以判断出该固体混合物可能为碳酸和过氧化钠的混合物;
B.【实验和推断】(1)过滤需要用的漏斗,而在溶解过程中玻璃棒的作用是加速溶解;
(2)碳酸钠可以和氯化钙反应生成碳酸钙沉淀,故可以判断碳酸钠的存在;
(3)过氧化钠可以水反应生成氢氧化钠,若a为无色,说明没有过氧化钠,若无色酚酞变红则说明存在着过氧化钠;
【反思与拓展】①根据题给的资料可以知道过氧化钠和二氧化碳反应生成碳酸钠和氧气;
②在潜水艇中有限的空间内,可以利用过氧化钠来吸收空气中的二氧化碳.
故答案为:【设计实验】(1)除去未反应的CO2;偏大;
(2)A猜想:是碳酸钠和过氧化钠的混合物;B;
B.【实验和推断】(1)漏斗;加速溶解;
(2)Na2CO3Na2CO3+CaCl2═CaCO3↓+2NaCl;
(3)Ⅰ;无色酚酞试液变红色;
【反思与拓展】①2Na2O2+2CO2═2Na2CO3+O2;
②在常温下反应(或能吸收人呼出的CO2等).
(2)A、根据反应的进行可以对固体的成分作出推测;
B.【实验和推断】(1)根据过滤操作来选择装置;
(2)能够和氯化钙反应生成白色沉淀的是碳酸钠;
(3)加入酚酞若仍然呈现无色说明没有过氧化钠,若变为红色则说明存在着过氧化钠;
【反思与拓展】①根据提示可以写反应的化学方程式;
②根据反应的产物和反应条件来进行分析.
解答:解:【设计实验】(1)由于参与反应的二氧化碳会影响反应的结果,如果不除去则会使量筒中水的体积偏大,所以应该除去;
(2)A、根据反应可以判断出该固体混合物可能为碳酸和过氧化钠的混合物;
B.【实验和推断】(1)过滤需要用的漏斗,而在溶解过程中玻璃棒的作用是加速溶解;
(2)碳酸钠可以和氯化钙反应生成碳酸钙沉淀,故可以判断碳酸钠的存在;
(3)过氧化钠可以水反应生成氢氧化钠,若a为无色,说明没有过氧化钠,若无色酚酞变红则说明存在着过氧化钠;
【反思与拓展】①根据题给的资料可以知道过氧化钠和二氧化碳反应生成碳酸钠和氧气;
②在潜水艇中有限的空间内,可以利用过氧化钠来吸收空气中的二氧化碳.
故答案为:【设计实验】(1)除去未反应的CO2;偏大;
(2)A猜想:是碳酸钠和过氧化钠的混合物;B;
B.【实验和推断】(1)漏斗;加速溶解;
(2)Na2CO3Na2CO3+CaCl2═CaCO3↓+2NaCl;
(3)Ⅰ;无色酚酞试液变红色;
【反思与拓展】①2Na2O2+2CO2═2Na2CO3+O2;
②在常温下反应(或能吸收人呼出的CO2等).

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目