题目内容
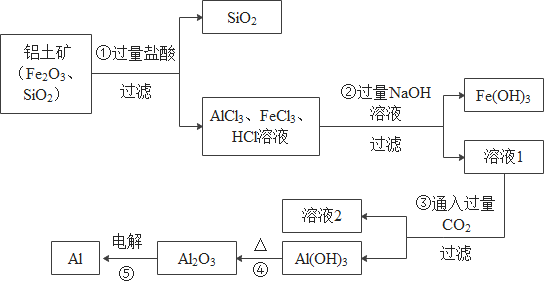
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
(1)请写出反应①中发生的一个反应的化学方程式________________。
(2)反应②除生成Fe (OH)3外,还生成了偏铝酸钠(NaAlO2), 溶液1中通入过量二氧化碳,生成氢氧化铝和另一种生活中常见的盐,已知两种生成物的质量比为78:84,请写出反应③的化学方程式___________。
(3)反应⑤中还生成了一种气体单质,请写出该反应的化学方程式________________。
【答案】Fe2O3+6HCl=2FeCl3+3H2O(或Al2O3+6HCl=2AlCl3+3H2O) NaAlO2+CO2+2H2O=Al(OH)3![]() +NaHCO3 2Al2O3
+NaHCO3 2Al2O3![]() 4Al+3O2
4Al+3O2![]()
【解析】
(1)铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,向其中加入过量的盐酸,盐酸与氧化铁反应生成氯化铁和水,与氧化铝反应生成氯化铝和水,化学方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,故填写:Fe2O3+6HCl=2FeCl3+3H2O(或Al2O3+6HCl=2AlCl3+3H2O);
(2)偏铝酸钠(NaAlO2)溶液中通入过量二氧化碳,生成氢氧化铝和另一种生活中常见的盐,根据质量守恒定律实质:化学反应前后,元素种类不变可知,反应生成物中有氢氧化铝,其中含有氢元素,因此,反应物中也含有氢元素,偏铝酸钠和二氧化碳中没有氢元素,因此,反应物必有三种,分别为:偏铝酸钠、二氧化碳和水,生成物除了氢氧化铝,含有另一种生活中常见的盐是钠盐,根据生成物的质量比为78:84,氢氧化铝的相对分子质量为78,则钠盐的相对分子质量为84,为碳酸氢钠,因此,反应③的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3![]() +NaHCO3,故填写:NaAlO2+CO2+2H2O=Al(OH)3
+NaHCO3,故填写:NaAlO2+CO2+2H2O=Al(OH)3![]() +NaHCO3;
+NaHCO3;
(3)根据质量守恒定律的实质可知,反应⑤生成的气体单质是氧气,故填写:2Al2O3![]() 4Al+3O2
4Al+3O2![]() 。
。

【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
(提出问题)它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
(实验探究1)向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
(得出结论1)三种溶液的碱性由强到弱的顺序为______。
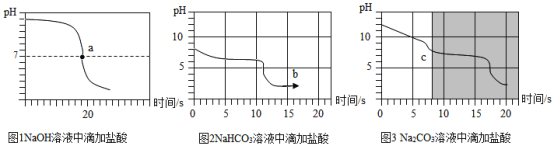
(实验探究2)甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由无色变为_____色。向其中加入稀盐酸,该反应的化学方程式为______。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示.
(得出结论2)从微观角度分析,该反应的实质是___________。
(实验探究3)向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
(交流与反思)b点的溶质为______(写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合。
(得出结论3)通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:Na2CO3+HCl=NaCl+NaHCO3、_____________。
(结论与反思)探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程。