题目内容
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算: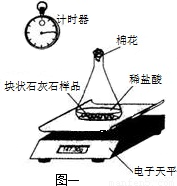
(1)欲配制14.6%的稀盐酸1000g,需用这种盐酸多少毫升?(计算结果精确到0.1)
| 盐酸(分析纯) 化学式:HCI 相对分子质量:36.5 密度1.18g/cm 质量分数:36% |
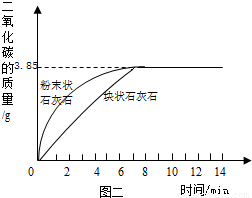
出二氧化碳的质量与反应时间的关系图(如图2).
①图1所示实验中数据记录纸上应该连续记录的实验数据是______和______.
②由图2中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越______,其反应速率越______.
③试求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出).______.
【答案】分析:(1)根据加水稀释前后溶液中溶质质量不变,由所要配制的稀盐酸中所含溶质的质量,利用标签中标注的浓盐酸的质量分数,可计算需用浓盐酸的体积;
(2)①根据测定实验的操作示意图及所得关系曲线,判断实验过程中所要记录的数据;
②对比等质量的两种固体形状不同的石灰石随反应时间增加所放出二氧化碳的曲线,判断石灰石形状对反应速率的影响;
③由完全反应所放出的二氧化碳,根据反应的化学方程式,计算反应所消耗碳酸钙的质量,求出样品中碳酸钙的质量分数.
解答:解:(1)设需用盐酸的体积为x
1000g×14.6%=x×1.18g/cm3×36%
x=343.7cm3
答:需用这种盐酸343.7毫升.
(2)①根据操作示意图,实验过程中对锥形瓶内所剩余物质的质量进行称量,由此得到反应时间与放出二氧化碳的质量关系,即连续记录的实验数据是:电子天平示数(或锥形瓶体系质量)和计时器示数(或反应时间);
②根据释放出二氧化碳的质量与反应时间的关系图,不难观察到:相同的反应时间内块状石灰石反应所产生二氧化碳的质量小于粉末状的石灰石;粉末状石灰石与盐酸的接触要比块状石灰石更充分,所以,可得到当其他条件相同时,接触面积越大(或小),其反应速度越快(或慢);
故答案为:
①电子天平示数(或锥形瓶体系质量),计时器示数(或反应时间)
②大,快(或小,慢)
③设每份样品中CaCO3的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 3.85g
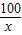 =
=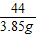 x=8.75g
x=8.75g
20.00g÷2=10.00g
样品中CaCO3质量分数=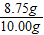 ×100%=87.5%
×100%=87.5%
答:样品中CaCO3质量分数为87.5%.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.
(2)①根据测定实验的操作示意图及所得关系曲线,判断实验过程中所要记录的数据;
②对比等质量的两种固体形状不同的石灰石随反应时间增加所放出二氧化碳的曲线,判断石灰石形状对反应速率的影响;
③由完全反应所放出的二氧化碳,根据反应的化学方程式,计算反应所消耗碳酸钙的质量,求出样品中碳酸钙的质量分数.
解答:解:(1)设需用盐酸的体积为x
1000g×14.6%=x×1.18g/cm3×36%
x=343.7cm3
答:需用这种盐酸343.7毫升.
(2)①根据操作示意图,实验过程中对锥形瓶内所剩余物质的质量进行称量,由此得到反应时间与放出二氧化碳的质量关系,即连续记录的实验数据是:电子天平示数(或锥形瓶体系质量)和计时器示数(或反应时间);
②根据释放出二氧化碳的质量与反应时间的关系图,不难观察到:相同的反应时间内块状石灰石反应所产生二氧化碳的质量小于粉末状的石灰石;粉末状石灰石与盐酸的接触要比块状石灰石更充分,所以,可得到当其他条件相同时,接触面积越大(或小),其反应速度越快(或慢);
故答案为:
①电子天平示数(或锥形瓶体系质量),计时器示数(或反应时间)
②大,快(或小,慢)
③设每份样品中CaCO3的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 3.85g
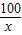 =
=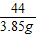 x=8.75g
x=8.75g20.00g÷2=10.00g
样品中CaCO3质量分数=
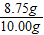 ×100%=87.5%
×100%=87.5%答:样品中CaCO3质量分数为87.5%.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目
 如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算: 如图是实验室所用盐酸试剂瓶上标签的部分内容,、请仔细阅读后计算:
如图是实验室所用盐酸试剂瓶上标签的部分内容,、请仔细阅读后计算: 如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
