题目内容
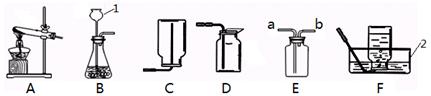
某同学改进的CO还原Fe2O3的实验装置如图所示.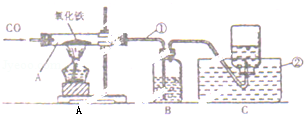
(1)写出图中有标号仪器的名称:① ,② .
(2)若先给Fe2O3加热再通入CO,可能产生的后果是 ,其原因是 .
(3)写出A中反应的化学方程式 .
(4)根据B装置中产生的现象,可判断反应是否开始发生,则B中的试剂是 .
(5)C装置的作用是 .
(1)导管;水槽;(2)发生爆炸;一氧化碳与空气混合达到爆炸极限时,在加热时会发生爆炸;(3)Fe2O3+3CO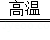 2Fe+3CO2;(4)澄清的石灰水;
2Fe+3CO2;(4)澄清的石灰水;
(5)收集未反应的一氧化碳,防止污染环境.
解析试题分析:(1)仪器①是导管;仪器②是水槽.(2)若先给氧化铁加热,一氧化碳和空气混合达到一氧化碳的爆炸极限时,在加热时会发生爆炸.(3)CO具有还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO 2Fe+3CO2.(4)一氧化碳在高温下还原氧化铁,生成二氧化碳,所以B装置中应该加入澄清的石灰水,如果B中的石灰水变浑浊,说明反应发生.(5)通过C装置可以把一氧化碳收集起来,防止对空气造成污染.
2Fe+3CO2.(4)一氧化碳在高温下还原氧化铁,生成二氧化碳,所以B装置中应该加入澄清的石灰水,如果B中的石灰水变浑浊,说明反应发生.(5)通过C装置可以把一氧化碳收集起来,防止对空气造成污染.
考点:一氧化碳还原氧化铁;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目