题目内容
【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 42 | 109 | 129 | 174 | 314 | 347 | |
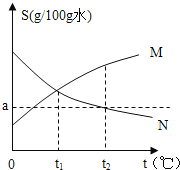
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示Ca(OH)2溶解度曲线的是_______(填“A”或“B”)。

(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,有下列措施:①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度。其中均可行的一组是______(填序号)
A.①②④ B.②③④ C.①③⑤ D.①②⑤
(3)20℃时,200g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH晶体的质量为________g。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量的CaO固体后,恢复到20℃,得到的溶液(乙溶液),已知:CaO + H2O = Ca(OH)2 。 则甲乙溶液中溶质的质量分数的关系为ω(乙)_____ω(甲)(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是________。
【答案】 略 略 略 略 略
【解析】(1)由表可知,氢氧化钠的溶解度随温度的升高而升高,氢氧化钙的溶解度随温度的升高而降低,故Ca(OH)2溶解度曲线的是A;
(2)氢氧化钙的溶解度随温度的升高而降低,故可以加入溶质,降低温度是不饱和的氢氧化钙溶液变为饱和溶液,①②⑤正确,故选D;
(3)20℃时,氢氧化钠的溶解度为109g,故10g水中能溶解氢氧化钠的质量是10.9g;
(4)向饱和的氢氧化钙溶液中加入氧化钙后,氧化钙可以与水反应生成氢氧化钙,反应耗掉了水分,生成了氢氧化钙,故有氢氧化钙析出,由于温度没变,故溶质的质量分数不变;
(5)氢氧化钠的溶解度随温度的升高而升高,氢氧化钙的溶解度随温度的升高而降低,故可以采用降温结晶的方法提取氢氧化钠;

 备战中考寒假系列答案
备战中考寒假系列答案