题目内容
(2013?金台区一模)把一定质量的纯净物A和9.6g B在一定条件下按下图所示充分反应,当B消耗完时,可生成8.8g D物质和5.4g E物质.

请回答下列问题:
(1)参加反应的A物质的质量是
(2)请判断A分子中是否含有氧元素
(3)试推断A物质的分子式

请回答下列问题:
(1)参加反应的A物质的质量是
4.6g
4.6g
.(2)请判断A分子中是否含有氧元素
含有
含有
(3)试推断A物质的分子式
C2H6O
C2H6O
.分析:(1)根据质量守恒定律,A物质的质量=D物质质量+E物质质量-B物质质量;
(2)先计算出D中含有的碳元素的质量和E中含有的氢元素的质量,两种元素质量之和与A的质量进行比较即可判断A中是否含有氧元素;
(3)先计算出A中含有的氧元素的质量,然后根据各元素的质量比和相对原子质量,求出个数比,从而得出化学式.
(2)先计算出D中含有的碳元素的质量和E中含有的氢元素的质量,两种元素质量之和与A的质量进行比较即可判断A中是否含有氧元素;
(3)先计算出A中含有的氧元素的质量,然后根据各元素的质量比和相对原子质量,求出个数比,从而得出化学式.
解答:解:(1)根据质量守恒定律,参加反应的A物质的质量是=8.8g+5.4g-9.6g=4.6g;
故答案为:4.6g;
(2)由图知,D是二氧化碳,8.8g二氧化碳中碳元素的质量为:8.8g×(
×100%)=2.4g;
E是水,5.4g水中氢元素的质量为:5.4g×(
×100%)=0.6g;
2.4g+0.6g=3g<4.6g,
因此A中一定含有氧元素;
故答案为:含有;
(3)根据质量守恒定律,二氧化碳中碳元素、水中氢元素都来自A,又A中氧元素的质量为4.6g-3g=1.6g,故A中各元素的质量比m(C):m(H):m(O)=2.4g:0.6g:1.6g=12:3:8,所以碳、氢、氧原子个数比为:
:
:
=2:6:1,则A的化学式为C2H6O.
故答案为:C2H6O.
故答案为:4.6g;
(2)由图知,D是二氧化碳,8.8g二氧化碳中碳元素的质量为:8.8g×(
| 12 |
| 44 |
E是水,5.4g水中氢元素的质量为:5.4g×(
| 2 |
| 18 |
2.4g+0.6g=3g<4.6g,
因此A中一定含有氧元素;
故答案为:含有;
(3)根据质量守恒定律,二氧化碳中碳元素、水中氢元素都来自A,又A中氧元素的质量为4.6g-3g=1.6g,故A中各元素的质量比m(C):m(H):m(O)=2.4g:0.6g:1.6g=12:3:8,所以碳、氢、氧原子个数比为:
| 12 |
| 12 |
| 3 |
| 1 |
| 8 |
| 16 |
故答案为:C2H6O.
点评:本题主要考查学生根据质量守恒定律解答问题的能力,学生需认真分析微粒示意图,才能正确解答.

练习册系列答案
相关题目
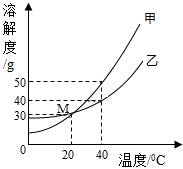 (2013?金台区一模)甲、乙两种固体的溶解度曲线如右图所示.下列说法中,不正确的是( )
(2013?金台区一模)甲、乙两种固体的溶解度曲线如右图所示.下列说法中,不正确的是( )