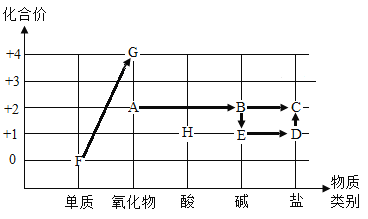
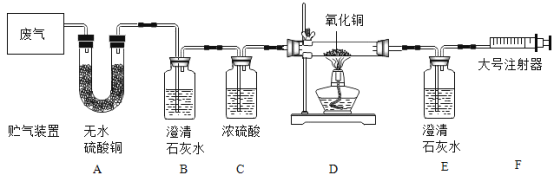
题目内容
【题目】某兴趣小组需要配制100g质量分数为9.8%的稀硫酸,假设常温下该稀硫酸的pH值为0。在装有100g该稀硫酸的烧杯中加入104.4gNa2CO3溶液,恰好完全反应,溶液呈中性。
(1)实验室只有98%的浓硫酸,密度为1.84g/cm3。需要用量筒量取_________________
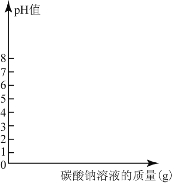
(2)在如图中,画出烧杯内溶液的pH值变化图象。(标出Na2CO3溶液的质量)
(3)计算所得溶液的溶质质量分数是多少?(写出计算过程)
【答案】(1)5.4mL(2)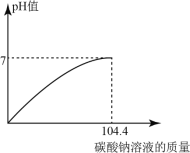 (3)7.1%
(3)7.1%
【解析】
(1)100g质量分数为9.8%的稀硫酸需要硫酸的质量为9.8g,所以需要密度为1.84g/cm3的98%的浓硫酸的体积=![]() ;
;
(2)稀硫酸和碳酸钠反应生成硫酸钠、二氧化碳和水,溶液pH不断增大,加入104.4gNa2CO3溶液时,恰好反应,溶液pH=7,所以图像为 。
。
(3)所得溶液的溶质为Na2SO4,设其质量为x,生成CO2的质量为y。
![]()
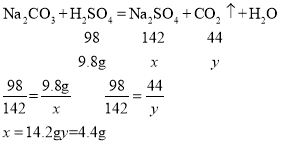
所得溶液的溶质质量分数![]()

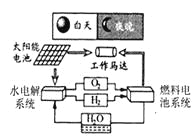
【题目】二氧化氮为红棕色的大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NO2还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。已知实验室采用NH4Cl和熟石灰反应制取,该反应类型为复分解反应,且氨气极易溶于水。回答下列问题:
(1)氨气的制备
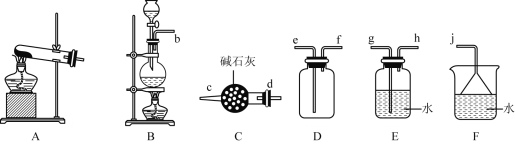
①发生装置可以选择上图中的_____________,反应的化学方程式为_____________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_____________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好),在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中_____________ | ②反应的化学方程式______________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | ③______________ | ④______________ |
打开K2 | ⑤______________ | 反应后气体分子数减少,Y管中压强小于外压 |