题目内容
【题目】某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究。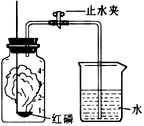
(1)如上图所示装置和药品进行实验,待红磷燃烧熄灭、装置冷却后打开止水夹后看到。
(2)小明同学认为可用木炭代替红磷测定空气中氧气的含量,小丽同学认为不可以,其原因是。
(3)小芳同学用镁条代替红磷来测定空气中氧气的含量。结果却发现倒吸的水量远远超过集气瓶内空气体积的1/5。你认为造成此现象的原因可能是。
A.装置有点漏气
B.没有冷却到室温就打开止水夹
C.镁条的量不足
D.镁条与空气中的其它气体发生了反应
(4)小组内同学反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择和生成物的要求上应考虑的是。
(5)小组内同学还对该实验进行了如下改进。(已知试管容积为 35mL).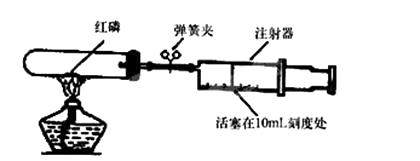
实验的操作步骤如下:①点燃酒精灯。 ②撤去酒精灯,待试管冷却后松开弹簧夹。
③将少量红磷平装入试管中,将20mL的注射器活塞置于11mL刻度处,并按上图中所示的连接方式固定好,再将弹簧夹紧橡皮管。 ④读取注射器活塞的数据。
你认为正确的实验操作顺序是(填字母符号)。
A. ①③②④ B. ③①②④ C. ③①④②
待试管冷却后松开弹簧夹,注射器活塞将从11mL刻度处慢慢前移到约为mL刻度处才停止。
【答案】
(1)烧杯中的冷水,倒吸进入集气瓶中,约占瓶内空气体积的五分之一
(2)木炭燃烧消耗氧气的同时产生等体积的气体二氧化碳
(3)D
(4)可燃物只能和空气中的氧气反应,生成物必须是固体
(5)B,4
【解析】测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。(1)实验中,待红磷燃烧熄灭、装置冷却后打开止水夹后看到烧杯中的冷水,倒吸进入集气瓶中,约占瓶内空气体积的五分之一 ; (2). 木炭燃烧消耗氧气的同时产生等体积的气体二氧化碳,使瓶内气体不减少,压强也不变小,水不会倒流; (3). D (4). 可燃物只能和空气中的氧气反应 ,生成物必须是固体 (5). A.装置有点漏气通常可能会导致测定结果偏小; B.没有冷却到室温就打开止水夹,会因为气体膨胀使剩余气体占有的体积多余空气的五分之四,而导致倒流的水少于五分之一,测定结果偏小;C.镁条的量不足,因氧气有剩余,导致测定结果偏小;D.镁条与空气中的其它气体发生了反应导致空气中被消耗的气体偏多,而使测定结果偏大; (6). 反应前容器内气体总量为45mL,其中氧气约为9mL,所以反应结束后,注射器活塞将从11mL刻度处慢慢前移到约为11 mL刻度处才停止。

 精英口算卡系列答案
精英口算卡系列答案【题目】下列现象或事实,用分子、原子的相关知识加以解释,其中不正确的是
现象或事实 | 解释 | |
A. | 稀有气体可作保护气 | 原子核外电子达到相对稳定结构 |
B. | 氧气和臭氧(O3)性质不完全相同 | 构成物质的分子不同 |
C. | 物质热胀冷缩 | 分子大小随温度改变而改变 |
D. | 水通电分解 | 在化学变化中分子可以再分 |
A.AB.BC.CD.D