题目内容
【题目】我国科学家侯德榜创立候氏制碱法为纯碱和化肥工业的发展做出了杰出贡献。下图1是候氏制碱法的反应原理,图2是相关物质的溶解度曲线,请结合图示回答下列问题:
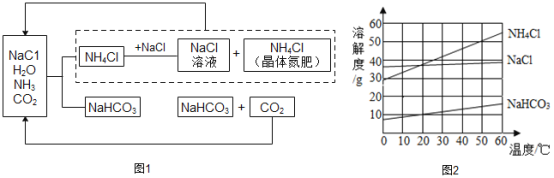
(1)制碱的主要反应原理:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3,生成的碳酸氢钠和氯化铵哪种物质首先析出?_______;理由是_______;
(2)该过程中除水外.能够循环利用的物质是_______;
(3)写出NaHCO3→Na2CO3 反应的化学方程式____________;
(4)50°C时,向100g水中加入55g氯化铵充分搅拌,所得溶液为____(填“饱和”或“不饱和”)溶液;
(5)60°C时,向等质量的氯化钠、碳酸氢钠、氯化铵中,分别加人水配成饱和溶液,所得溶液的质量由小到大的顺序是_______。
【答案】碳酸氢钠(或NaHCO3) 相同温度下,NaHCO3的溶解度远小于NH4Cl的溶解度 氯化钠、二氧化碳(或NaCl、CO2) 2NaHCO3![]() Na2CO3+H2O+CO2↑ 饱和 氯化铵、氯化钠、碳酸氢钠(或NH4Cl、NaCl、NaHCO3)
Na2CO3+H2O+CO2↑ 饱和 氯化铵、氯化钠、碳酸氢钠(或NH4Cl、NaCl、NaHCO3)
【解析】
(1)制碱的主要反应原理:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3,生成的碳酸氢钠的溶解度比氯化铵小,碳酸氢钠(或NaHCO3)首先析出;
(2)该反应有两步反应,第一步是氨气、氯化钠、水、二氧化碳反应生成碳酸氢钠和氯化铵,第二步是碳酸氢钠在加热条件下生成二氧化碳、碳酸钠、水;将碳酸氢钠过滤后,得溶液是氯化钠的饱和溶液,该过程中除水外,能够循环利用的物质是氯化钠、二氧化碳(或NaCl、CO2) ;
(3)NaHCO3→Na2CO3 反应的化学方程式2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(4)由图可知,50°C时,氯化铵的溶解度为50g,即100g水中溶解50g氯化铵达到饱和,向100g水中加入55g氯化铵充分搅拌,所得溶液为饱和溶液;
(5)60°C时,氯化钠、碳酸氢钠、氯化铵的溶解度大小顺序是:氯化铵>氯化钠>碳酸氢钠,溶解度越大,配成饱和溶液需要的水越少,所得溶液质量越少,向等质量的氯化钠、碳酸氢钠、氯化铵中,分别加人水配成饱和溶液,所得溶液的质量由小到大的顺序是氯化铵<氯化钠<碳酸氢钠。