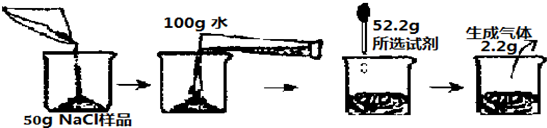
题目内容
在一次化学课外活动中,某同学想除去氯化钾固体中混有的氯化铜(不引进其它杂质).他现取氯化钾和氯化铜的混合物59.8g,全部溶解在200g水中,再加上60g氢氧化钾溶液,恰好完全反应,生成沉淀9.8g.
试计算:
(1)混合物中氯化铜的质量;
(2)反应后所得溶液中溶质的质量分数.(精确到0.1%)
解:设要生成9.8g氢氧化铜沉淀,需要参加反应的氯化铜的质量为X,同时生成氯化钾的质量为Y,则:
CuCl2+2KOH═Cu(OH)2↓+2KCl
135 98 149
X 9.8g Y
根据: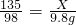 解得X=13.5g,根据:
解得X=13.5g,根据: 解得Y=14.9g.
解得Y=14.9g.
(1)氯化铜质量为13,5g;
(2)原来的氯化钾质量为:59.8g-13.5g=46.3g,反应后总氯化钾质量为:46.3g+14.9g=61.2g,反应后溶液质量为:59.8g+200g+60g-9.8g=310g,所以反应后所得溶液中溶质的质量分数: ×100%=19.7%
×100%=19.7%
故答案为:(1)CuCl2质量为13.5克KCl质量为14.9克.(2)19.7%
分析:(1)根据沉淀的质量算出氯化铜的质量;(2)根据沉淀质量算出反应生成的氯化钾的质量,再算出原来的氯化钾,加在一块就是反应后溶质质量,再算出反应后溶液质量,用溶质质量除以溶液质量乘以百分之百即可.
点评:解答本题容易出错的地方是反应后溶质质量忘记加上原来的氯化钾,算溶液质量时有的同学忘记减去沉淀的质量.
CuCl2+2KOH═Cu(OH)2↓+2KCl
135 98 149
X 9.8g Y
根据:
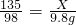 解得X=13.5g,根据:
解得X=13.5g,根据: 解得Y=14.9g.
解得Y=14.9g.(1)氯化铜质量为13,5g;
(2)原来的氯化钾质量为:59.8g-13.5g=46.3g,反应后总氯化钾质量为:46.3g+14.9g=61.2g,反应后溶液质量为:59.8g+200g+60g-9.8g=310g,所以反应后所得溶液中溶质的质量分数:
 ×100%=19.7%
×100%=19.7%故答案为:(1)CuCl2质量为13.5克KCl质量为14.9克.(2)19.7%
分析:(1)根据沉淀的质量算出氯化铜的质量;(2)根据沉淀质量算出反应生成的氯化钾的质量,再算出原来的氯化钾,加在一块就是反应后溶质质量,再算出反应后溶液质量,用溶质质量除以溶液质量乘以百分之百即可.
点评:解答本题容易出错的地方是反应后溶质质量忘记加上原来的氯化钾,算溶液质量时有的同学忘记减去沉淀的质量.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目