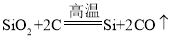题目内容
【题目】某化学兴趣小组的同学在学完酸和碱的化学性质实验后,做了如下实验,并对实验过程进行了探究:
实验1:将一定量的稀盐酸倒人盛有氧化铜粉末的烧杯A中,实验观察到的现象是_______________,充分反应后得到溶液B。烧杯A中发生反应的化学方程式为___________________。
实验2:向溶液B中滴加一定量的氢氧化钠溶液,开始无明显现象,一段时间后发现溶液中出现了蓝色沉淀,过滤后得到滤液C。
[提出问题]滤液C中含有哪些溶质?
[猜想与假设]
小可认为:含有NaCl;
小凡认为:含有NaCl和HCl;
小燕认为:含有NaCl和NaOH;
小楠认为:含有_______________。
[讨论与交流](1)同学们经过讨论后,--致认为小凡的猜想不正确,你认为其中的理由是______________。
(2)小可经过观察,发现滤液C呈无色,认为自己的猜想正确,小楠的猜想是错误的。经过讨论,同学们也否定了小可的观点,原因是_______________。
(3)当向溶液B中滴加氢氧化钠溶液的过程中,刚开始出现蓝色沉淀时,溶液B中所含的离子是__________。
实验3:小楠取滤液C于试管中,加入无色酚酞溶液,观察到的现象为______________。于是同学们得出了结论:小燕的猜想正确。
[反思拓展](1)探究反应后所得溶液的溶质成分时,不仅要考虑生成物,还要考虑反应物是否过量。
(2)上述实验体现酸的两个化学性质,即酸能与金属氧化物反应、酸能与碱反应。
【答案】黑色粉末逐渐溶解,溶液由无色变为蓝色 ![]() NaCl和CuCl2 如果滤液中含有HCl,则不可能产生蓝色沉淀 氯化铜溶液蓝色,小楠的猜想错误,氯化钠、氢氧化钠均为无色,也可能是小燕的猜想正确。 Na+ 、Cu2+、Cl- 溶液变红
NaCl和CuCl2 如果滤液中含有HCl,则不可能产生蓝色沉淀 氯化铜溶液蓝色,小楠的猜想错误,氯化钠、氢氧化钠均为无色,也可能是小燕的猜想正确。 Na+ 、Cu2+、Cl- 溶液变红
【解析】
(1)氧化铜与稀盐酸反应生成氯化铜和水,观察到的现象为黑色粉末逐渐溶解,溶液由无色变为蓝色,反应的化学方程式为![]() 。
。
(2)根据实验1可知:稀盐酸与氧化铜反应生成氯化铜和水,若氯化铜过量,滤液C还可能是NaCl和CuCl2。
(3)如果滤液中含有HCl,则不可能产生蓝色沉淀,所以小凡的猜想不正确;
(4)因为滤液C是无色的,说明没有氯化铜,小楠的猜想错误;但氢氧化钠也为无色,无法确定溶液中是否含有氢氧化钠,所以小燕的猜想可能正确
(5)向溶液B中滴加一定量的氢氧化钠溶液,开始无明显现象,说明A烧杯中溶液的溶质为氯化铜、氯化氢。当溶液B中刚开始出现蓝色沉淀,说明氢氧化钠将过量的盐酸反应完,生成氯化钠,NaOH开始与氯化铜反应。所以溶液中所含的离子为Na+ 、Cu2+、Cl-。
(6)根据滤液C中加入酚酞溶液,得出小燕的猜想正确,即溶液中除氯化钠外,还有氢氧化钠,则加入酚酞溶液后,溶液变成红色。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案