题目内容
甲乙两烧杯中分别盛有等体积、等浓度的硫酸溶液.向甲杯中放入m克镁,向乙杯中投入m克锌.完全反应后发现有一烧杯中金属有剩余.则各杯中原来硫酸的质量x之值是( )
A.x=
| B.
| ||||||||
C.
| D.
|
设m克镁全参加反应消耗的硫酸的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 98
mg x
=
x=
g
设m克锌全参加反应消耗的硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
mg y
=
y=
g
x>y,所以等质量的镁比锌消耗的稀硫酸多,所以等体积、等浓度的硫酸溶液完全反应后有一烧杯中金属有剩余,剩余的金属是镁,锌全反应加入金属镁的稀硫酸全反应.原来硫酸的质量介于
g和
g这二者之间,但不能等于最大值因为镁有剩余,故答案选D.
Mg+H2SO4=MgSO4+H2↑
24 98
mg x
| 24 |
| mg |
| 98 |
| x |
x=
| 98m |
| 24 |
设m克锌全参加反应消耗的硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
mg y
| 65 |
| mg |
| 98 |
| y |
y=
| 98m |
| 65 |
x>y,所以等质量的镁比锌消耗的稀硫酸多,所以等体积、等浓度的硫酸溶液完全反应后有一烧杯中金属有剩余,剩余的金属是镁,锌全反应加入金属镁的稀硫酸全反应.原来硫酸的质量介于
| 98m |
| 65 |
| 98m |
| 24 |

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
 m克
m克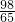 m
m m克
m克 m>x>
m>x>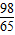 m
m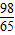 m>x≥
m>x≥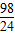 m
m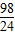 m>x≥
m>x≥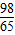 m
m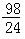 m克
m克 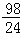 m>x>
m>x>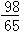 m
m 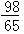 m>x≥
m>x≥ 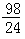 m
m 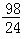 m>x≥
m>x≥ 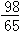 m
m