题目内容
甲乙两烧杯中分别盛有等体积、等浓度的硫酸溶液.向甲杯中放入m克镁,向乙杯中投入m克锌.完全反应后发现有一烧杯中金属有剩余.则各杯中原来硫酸的质量x之值是
- A.x=
 m克
m克 - B.
 m>x>
m>x>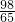 m
m - C.
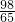 m>x≥
m>x≥ m
m - D.
 m>x≥
m>x≥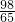 m
m
D
分析:根据镁和稀硫酸反应生成硫酸镁和氢气、锌和稀硫酸反应生成硫酸锌和氢气这两个化学方程式计算即可解答.
解答:设m克镁全参加反应消耗的硫酸的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 98
mg x
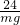 =
=
x=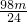 g
g
设m克锌全参加反应消耗的硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
mg y
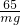 =
=
y=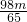 g
g
x>y,所以等质量的镁比锌消耗的稀硫酸多,所以等体积、等浓度的硫酸溶液完全反应后有一烧杯中金属有剩余,剩余的金属是镁,锌全反应加入金属镁的稀硫酸全反应.原来硫酸的质量介于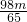 g和
g和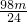 g这二者之间,但不能等于最大值因为镁有剩余,故答案选D.
g这二者之间,但不能等于最大值因为镁有剩余,故答案选D.
点评:本题解题的关键是根据化学方程式求出等质量的金属镁和锌全反应消耗的硫酸的质量,可得出等质量的镁消耗的酸多,所以若酸同样多肯定镁有剩余,锌全反应所以酸的量介于mg锌和镁全反应消耗的酸的质量之间但要注意不能等于mg镁全反应消耗的酸的质量.
分析:根据镁和稀硫酸反应生成硫酸镁和氢气、锌和稀硫酸反应生成硫酸锌和氢气这两个化学方程式计算即可解答.
解答:设m克镁全参加反应消耗的硫酸的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 98
mg x
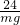 =
=
x=
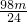 g
g设m克锌全参加反应消耗的硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
mg y
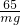 =
=
y=
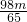 g
gx>y,所以等质量的镁比锌消耗的稀硫酸多,所以等体积、等浓度的硫酸溶液完全反应后有一烧杯中金属有剩余,剩余的金属是镁,锌全反应加入金属镁的稀硫酸全反应.原来硫酸的质量介于
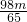 g和
g和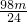 g这二者之间,但不能等于最大值因为镁有剩余,故答案选D.
g这二者之间,但不能等于最大值因为镁有剩余,故答案选D.点评:本题解题的关键是根据化学方程式求出等质量的金属镁和锌全反应消耗的硫酸的质量,可得出等质量的镁消耗的酸多,所以若酸同样多肯定镁有剩余,锌全反应所以酸的量介于mg锌和镁全反应消耗的酸的质量之间但要注意不能等于mg镁全反应消耗的酸的质量.

练习册系列答案
相关题目
 m克
m克 m>x>
m>x>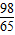 m
m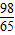 m>x≥
m>x≥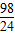 m
m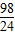 m>x≥
m>x≥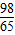 m
m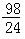 m克
m克 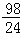 m>x>
m>x>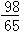 m
m 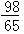 m>x≥
m>x≥ 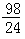 m
m 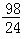 m>x≥
m>x≥ 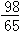 m
m