题目内容
为了测定硫酸铜晶体(CuSO 4.xH2O)中的x值,做下列实验,将硫酸铜晶体放在坩埚中加热,至不含结晶水(CuSO 4.xH2O CuSO 4+xH2O)),测得数据见表.
CuSO 4+xH2O)),测得数据见表.| 质量/g | |
| 坩埚+硫酸铜晶体 | 44.5 |
| 坩埚+无水硫酸铜 | 35.5 |
| 坩 埚 | 19.5 |
(1)反应共生成水______g;
(2)x的值为______;
(3)取该种晶体5g溶于45g水中,完全溶解后得到的硫酸铜溶液中溶质的质量分数是多少?
【答案】分析:(1)根据反应前后的固体质量的差来计算水的质量;
(2)根据CuSO 4.xH2O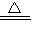 CuSO 4+xH2O,利用硫酸铜的质量与水的质量代入方程式计算x;
CuSO 4+xH2O,利用硫酸铜的质量与水的质量代入方程式计算x;
(3)根据晶体中硫酸铜的质量及完全溶解后溶液的质量来计算溶质的质量分数.
解答:解:(1)由表格中的数据,水的质量为反应前后固体质量的差,
则水的质量为44.5g-35.5g=9g,故答案为:9;
(2)由表格中的数据,硫酸铜的质量为35.5g-19.5g=16g,
则CuSO 4.xH2O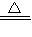 CuSO 4+xH2O,
CuSO 4+xH2O,
160 18x
16g 9g
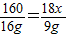 ,解得x=5,故答案为:5;
,解得x=5,故答案为:5;
(3)由CuSO 4.5H2O可知,
5g晶体中含有硫酸铜的质量为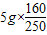 ,
,
因完全溶解,则溶液的质量为5g+45g,
则硫酸铜溶液中溶质的质量分数: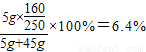 ,
,
答:硫酸铜溶液中溶质的质量分数为6.4%.
点评:本题考查学生利用试验数据来分析数据并应用数据进行计算,较好的训练了学生对实验数据的分析应用能力,并应熟悉化学方程式及溶质质量分数的计算来解答.
(2)根据CuSO 4.xH2O
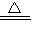 CuSO 4+xH2O,利用硫酸铜的质量与水的质量代入方程式计算x;
CuSO 4+xH2O,利用硫酸铜的质量与水的质量代入方程式计算x;(3)根据晶体中硫酸铜的质量及完全溶解后溶液的质量来计算溶质的质量分数.
解答:解:(1)由表格中的数据,水的质量为反应前后固体质量的差,
则水的质量为44.5g-35.5g=9g,故答案为:9;
(2)由表格中的数据,硫酸铜的质量为35.5g-19.5g=16g,
则CuSO 4.xH2O
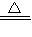 CuSO 4+xH2O,
CuSO 4+xH2O,160 18x
16g 9g
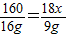 ,解得x=5,故答案为:5;
,解得x=5,故答案为:5;(3)由CuSO 4.5H2O可知,
5g晶体中含有硫酸铜的质量为
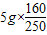 ,
,因完全溶解,则溶液的质量为5g+45g,
则硫酸铜溶液中溶质的质量分数:
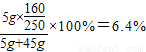 ,
,答:硫酸铜溶液中溶质的质量分数为6.4%.
点评:本题考查学生利用试验数据来分析数据并应用数据进行计算,较好的训练了学生对实验数据的分析应用能力,并应熟悉化学方程式及溶质质量分数的计算来解答.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
为了测定硫酸铜晶体中的x值,将一定质量的这种硫酸铜晶体放入坩埚中,称量、加热、称量、再加热、再称量直至不含结晶水.实验中得到如下数据:
根据表中数据判断,下列结论不正确的是( )
A.坩埚质量为19.13g
B.硫酸铜晶体的质量为2.48g
C.无水硫酸铜的质量为1.59g
D.结晶水的质量为0.63g
| 称量次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 物品 | 坩埚 | 坩埚+试剂 | 坩埚+试剂 | 坩埚+试剂 | 坩埚+试剂 |
| 质量/g | 19.13 | 21.61 | 20.98 | 20.72 | 20.72 |
A.坩埚质量为19.13g
B.硫酸铜晶体的质量为2.48g
C.无水硫酸铜的质量为1.59g
D.结晶水的质量为0.63g
为了测定硫酸铜晶体(CuSO 4.xH2O)中的x值,做下列实验,将硫酸铜晶体放在坩埚中加热,至不含结晶水(CuSO 4.xH2O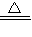 CuSO 4+xH2O)),测得数据见表.
CuSO 4+xH2O)),测得数据见表.
根据实验数据推断:
(1)反应共生成水______g;
(2)x的值为______;
(3)取该种晶体5g溶于45g水中,完全溶解后得到的硫酸铜溶液中溶质的质量分数是多少?
 CuSO 4+xH2O)),测得数据见表.
CuSO 4+xH2O)),测得数据见表.| 质量/g | |
| 坩埚+硫酸铜晶体 | 44.5 |
| 坩埚+无水硫酸铜 | 35.5 |
| 坩 埚 | 19.5 |
(1)反应共生成水______g;
(2)x的值为______;
(3)取该种晶体5g溶于45g水中,完全溶解后得到的硫酸铜溶液中溶质的质量分数是多少?
