题目内容
【题目】某兴趣小组的同学在实验室发现了一块绿色的孔雀石标本,查阅资料知其主要成分是 Cu2(OH)2CO3。他们以Cu2(OH)2CO3为原料制取铜,其工艺流程如下图所示:

(1)气体A的化学式是________,固体C中含有的物质有_______(填化学式)。
(2)写出溶液B与铁粉反应的化学方程式:__________________。
(3)结合流程图分析,试剂E可以是下列类别中的___________(填选项)。
A 单质 B 酸溶液 C 碱溶液 D 盐溶液
(4)若试剂E是无色溶液,且反应生成溶液D和气体,写出C与E反应的化学方程式: ____________,该反应的基本类型属于__________。
(5)该工艺流程的实验步骤中,能够体现出铁的金属活动性比铜强的有___________。
A ①②③ B ②③ C 只有② D 只有③
【答案】CO2 Cu、Fe ![]() BD
BD ![]() 置换反应 B
置换反应 B
【解析】
(1)碱式碳酸铜中含有碳酸根,与稀硫酸反应可以生成二氧化碳,所以A为CO2;铁的金属活动性强于铜,所以铁会与硫酸铜反应生成硫酸亚铁和铜,而铁又过量,所以固体除了生成的铜,还有剩余的铁,所以C含有Cu、Fe;
(2)蓝色溶液为硫酸铜溶液,铁与硫酸铜反应生成硫酸亚铁和铜,所以该反应的化学方程式为![]() ;
;
(3)A、C中固体为铁与铜,都是单质,加入另外一种单质,不会发生反应,无法将铜和铁分离,选项A不符合题意;
B、金属活动性为铁>氢>铜,加入酸后,铁与酸反应生成含铁的盐和氢气,盐留在溶液中,氢气逸出,铜与酸不发生反应,成为固体,经过过滤得到了溶液和单质铜,选项B符合题意;
C、铁和铜都不与碱溶液发生反应,仍为固体混合物,无法得到铜,选项C不符合题意;
D、加入含铜的盐溶液,如氯化铜、硝酸铜等,铁可与其反应置换出铜单质,而铁则变为可溶性盐形成溶液,实现铁和铜的分离,得到单质铜,选项D符合题意;故选BD。
(4)E为无色溶液,则不是含有铜离子的盐溶液,则E为酸,与C反应生成了D硫酸亚铁,则推出E为稀硫酸,所以C中的铁与稀硫酸反应生成硫酸亚铁和氢气,发生反应的化学方程式为![]() ;反应为单质与一种化合物反应生成另一种单质和化合物,符合置换反应的特点,所以为置换反应;
;反应为单质与一种化合物反应生成另一种单质和化合物,符合置换反应的特点,所以为置换反应;
(5)步骤②中铁与硫酸铜反应置换出铜单质,体现了铁的金属活动性比铜强;步骤③中若加入酸,铁与酸反应置换出气体,而铜不能与酸反应,说明铁金属活动性比铜强,若加入含铜的盐,铁与盐反应置换出铜单质,也说明铁金属活动性比铜强,所以步骤②和③都可以证明铁金属活动性比铜强,故选B。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案【题目】氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
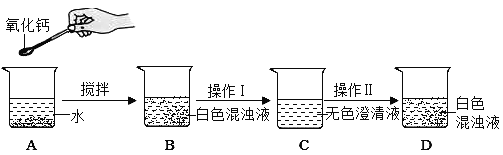
(1)A中发生反应的化学方程式为_____。分离B中难溶物的操作Ⅰ叫_____
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列_____(填序号)进行实验。
①稀盐酸 ②酚酞试液 ③二氧化碳 ④氯化钠溶液
(3)操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是_____;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是_____。
(查阅资料)工业铁红主要成分是Fe2O3,还含有少量的FeO,Fe3O4
(1)草酸晶体(H2C2O4,·3H2O)在浓硫酸作用下受热分解,化学方程式_____。
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(问题讨论)为了测定铁红中铁的质量分数,小组同学进行如下实验。(装置气密性良好)
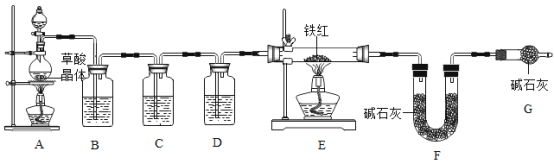
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(2)C装置的作用是_____。
(3)写出E装置中所发生反应的一个化学方程式:_____。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为m g,则_____<m<_____。
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是_____
(实验反思)
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”或“偏大”)。
(2)该实验装置的一个明显缺陷是_____。