题目内容
某石灰厂新到一批石灰石,其中含有杂质二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温不分解)为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组实验测得数据如下表:
| 实验次数 | 1 | 2 | 3 |
| 稀盐酸质量(g) | 50 | 50 | 100 |
| 样品质量(g) | 20 | 30 | 20 |
| 产生气体的质量(g) | 6.6 | 6.6 | 6.6 |
(2)求出该石灰石样品的纯度.
解:(1)对比实验1、2,当样品质量增加时,放出二氧化碳质量并未增加,说明实验中稀盐酸已完全反应;对比实验1、3,当稀盐酸质量增加时,放出二氧化碳的质量不变,说明实验中碳酸钙已完全反应;综上所述,20g样品能恰好和50g盐酸反应;
解:设20g 样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 6.6g
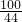 =
=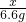
x=15g
则该石灰石样品的纯度为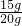 ×100%=75%;
×100%=75%;
故答案为:(1)1;(2)求出该石灰石样品的纯度为75%.
分析:(1)对三组实验数据进行分析,通过对比稀盐酸质量、样品质量、产生气体的质量三者间的关系,判断反应进度及反应物剩余情况;
(2)利用第1或3组碳酸钙完全反应所得实验数据,根据反应的化学方程式,由产生二氧化碳质量计算样品中所含碳酸钙质量,求出该石灰石样品的纯度.
点评:石灰石的主要成分为碳酸钙,因此石灰石样品的纯度即主要成分碳酸钙在样品中的质量分数,即样品中所含碳酸钙质量与样品的质量比.
解:设20g 样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 6.6g
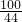 =
=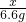
x=15g
则该石灰石样品的纯度为
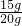 ×100%=75%;
×100%=75%;故答案为:(1)1;(2)求出该石灰石样品的纯度为75%.
分析:(1)对三组实验数据进行分析,通过对比稀盐酸质量、样品质量、产生气体的质量三者间的关系,判断反应进度及反应物剩余情况;
(2)利用第1或3组碳酸钙完全反应所得实验数据,根据反应的化学方程式,由产生二氧化碳质量计算样品中所含碳酸钙质量,求出该石灰石样品的纯度.
点评:石灰石的主要成分为碳酸钙,因此石灰石样品的纯度即主要成分碳酸钙在样品中的质量分数,即样品中所含碳酸钙质量与样品的质量比.

练习册系列答案
相关题目
某石灰厂新到一批石灰石,其中含有杂质二氧化硅(二氧化硅不溶于水,不溶
于盐酸,高温不分解).为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组
实验,测得数据如表:
(1)在空格中填写数据
(2)该实验中,第 (填数字)组同学的实验中,稀盐酸一定反应完全;第三组实验中, 一定有剩余.
(3)求出该石灰石样品的纯度 .
于盐酸,高温不分解).为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组
实验,测得数据如表:
| 实验次数 | 1 | 2 | 3 |
| 稀盐酸质量(g) | 50 | 50 | 100 |
| 样品质量(g) | 20 | 30 | 20 |
| 剩余物质质量(g) | 63.4 | 73.4 | 113.4 |
| 产生气体的质量(g) | 6.6 | 6.6 |
(2)该实验中,第
(3)求出该石灰石样品的纯度
某石灰厂新到一批石灰石,其中含有杂质二氧化硅(二氧化硅不溶于水,不溶
于盐酸,高温不分解).为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组
实验,测得数据如表:
(1)在空格中填写数据
(2)该实验中,第______(填数字)组同学的实验中,稀盐酸一定反应完全;第三组实验中,______一定有剩余.
(3)求出该石灰石样品的纯度______.
于盐酸,高温不分解).为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组
实验,测得数据如表:
| 实验次数 | 1 | 2 | 3 |
| 稀盐酸质量(g) | 50 | 50 | 100 |
| 样品质量(g) | 20 | 30 | 20 |
| 剩余物质质量(g) | 63.4 | 73.4 | 113.4 |
| 产生气体的质量(g) | 6.6 | 6.6 | ______ |
(2)该实验中,第______(填数字)组同学的实验中,稀盐酸一定反应完全;第三组实验中,______一定有剩余.
(3)求出该石灰石样品的纯度______.