题目内容
铁的冶炼是钢铁工业的基础。
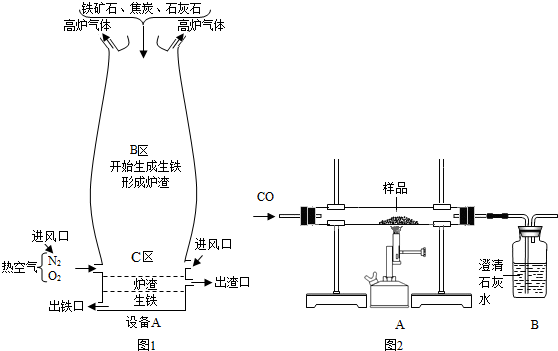
(Ⅰ)右图是教材中炼铁高炉及炉内化学变化过程示意图,若右图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:
(1) B区 (2) C区 、 。
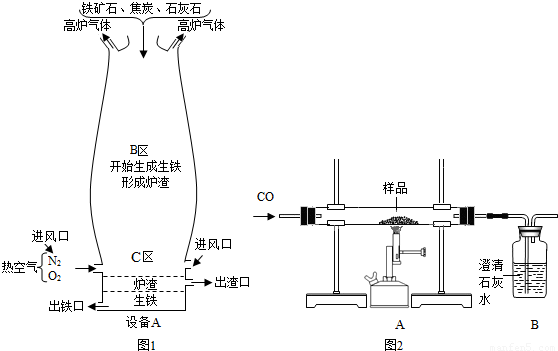
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如下图所示。
(3)该工艺流程中,甲烷的作用是 、 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(4)该工艺流程中,可循环利用的物质是 。
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。
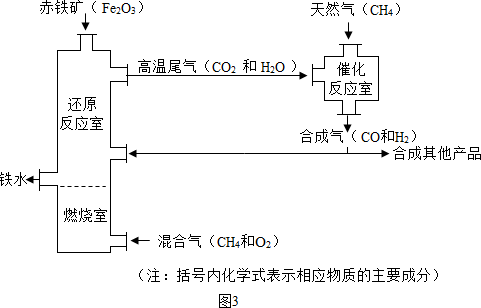
(Ⅳ)某兴趣小组同学利用下图装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32 g | 反应前55.72 g | 反应前 281.00 g |
| 反应后55.08 g | 反应后 281.56 g |
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是 。
②该样品所有可能的组成是 。
(I) (1) 3CO+Fe2O3高温 2Fe+3CO2
(2) C + O2点燃 CO2 2C + CO2 高温2CO
(II)(3)燃烧产生热量、做生产合成气的原料 混合物
(4)CO2和H2O(高温尾气)
(III)(5) 2HgO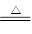 2Hg+O2↑ C + 2CuO 高温 2Cu+ CO2↑
2Hg+O2↑ C + 2CuO 高温 2Cu+ CO2↑
用金属还原金属氧化物
(Ⅳ)(6) 装置B不能将反应产生的CO2全部吸收
Fe3O4;Fe2O3、FeO;Fe3O4、Fe2O3、FeO
解析试题分析:(I)根据炼铁高炉的示意图可知,
(1)B区主要是生成铁的反应,所以反应的化学方程式为3CO+Fe2O3高温 2Fe+3CO2;
(2) C区主要是产生一氧化碳的反应,共发生了两个反应,所以反应的化学方程式为C + O2点燃 CO2 ,2C + CO2 高温2CO。
(II)(3)根据竖炉炼铁的流程图可知,甲烷和氧气混合气体进入燃烧室,可燃烧为炼铁提供热量;另外,还有一部分甲烷进入催化反应室,和二氧化碳、水等反应,可制得合成气(CO和H2)。由于在炼铁的过程中不可避免的会引入一些杂质,所以冶炼出的铁水属于混合物。
(4)根据高温尾气的成分为二氧化碳和水,它们进入催化反应室中可以得到合成气体(一氧化碳和氢气),而合成气体进入还原反应室,与氧化铁反应,又生成了二氧化碳和水,所以可以判断在该过程中能够被循环利用的物质为二氧化碳和水。
(III)(5) ①在初中化学中学过的能受热分解的金属氧化物只有氧化汞,氧化汞受热分解生成汞和氧气,故反应的化学方程式为2HgO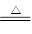 2Hg+O2↑;
2Hg+O2↑;
②金属氧化物有很多,最常见的为氧化铜,木炭在高温条件下还原氧化铜可以生成金属铜和二氧化碳气体,故反应的化学方程式为C + 2CuO 高温 2Cu+ CO2↑;
③根据化学反应的方程式可知,反应物和生成物都是一种金属单质和一种金属氧化物,因此可归纳其反应规律为:用金属还原金属氧化物。
(Ⅳ)(6)①由于装置B中盛有的是澄清石灰水即氢氧化钙溶液,而氢氧化钙是微溶于水的物质,故澄清石灰水中的氢氧化钙含量很少,不能将反应产生的CO2全部吸收,所以不选用装置B的质量变化来计算;
②根据还原反应的原理可知,在金属氧化物与CO的反应过程中,金属氧化物的氧会被夺去,故固体物质总质量会变小,而变小的质量即为金属氧化物中氧元素的质量,结合表格数据可知,氧元素的质量=55.72g-55.08g=0.64g,则混合物中氧元素的质量分数=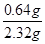 ×100%=27.6%,而Fe3O4中氧元素的质量分数=
×100%=27.6%,而Fe3O4中氧元素的质量分数=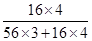 ×100%=27.6%,Fe2O3中氧元素的质量分数=
×100%=27.6%,Fe2O3中氧元素的质量分数=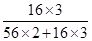 ×100%=30%,FeO中氧元素的质量分数=
×100%=30%,FeO中氧元素的质量分数=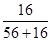 ×100%=22.2%;故该样品所有可能的组成是Fe3O4;Fe2O3、FeO;Fe3O4、Fe2O3、FeO。
×100%=22.2%;故该样品所有可能的组成是Fe3O4;Fe2O3、FeO;Fe3O4、Fe2O3、FeO。
考点:铁的冶炼,金属活动性顺序及其应用,金属活动性的探究,书写化学方程式,元素质量分数的计算
点评:本题考查的知识点较多,主要考查了铁的冶炼的有关知识,熟练掌握相关化学知识和实验的原理、现象和注意事项等是解答本题的关键。

 天天向上口算本系列答案
天天向上口算本系列答案铁的冶炼是钢铁工业的基础。
(Ⅰ)右图是教材中炼铁高炉及炉内化学变化过程示意图,若右图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:

(1) B区 (2) C区 、 。
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如下图所示。

(3)该工艺流程中,甲烷的作用是 、 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(4)该工艺流程中,可循环利用的物质是 。
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。

(Ⅳ)某兴趣小组同学利用下图装置进行相关实验,测定样品的组成:

(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
|
样品质量 |
装置A中玻璃管和固体的总质量 |
装置B的质量 |
|
2.32 g |
反应前55.72 g |
反应前 281.00 g |
|
反应后55.08 g |
反应后 281.56 g |
请回答下列问题:
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是 。
②该样品所有可能的组成是 。
铁的冶炼是钢铁工业的基础.


(Ⅰ)如图1是教材中炼铁高炉及炉内化学变化过程示意图,若图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:(1)B区______ (2)C区______、______.
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如图2所示.
(3)该工艺流程中,甲烷的作用是______、______,冶炼出的铁水属于______(填“纯净物”或“混合物”).
(4)该工艺流程中,可循环利用的物质是______.
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原.
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法.

(Ⅳ)某兴趣小组同学利用图3装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32g | 反应前55.72g | 反应前 281.00g |
| 反应后55.08g | 反应后 281.56g |
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是______.
②该样品所有可能的组成是______.