题目内容
铁的冶炼是钢铁工业的基础.


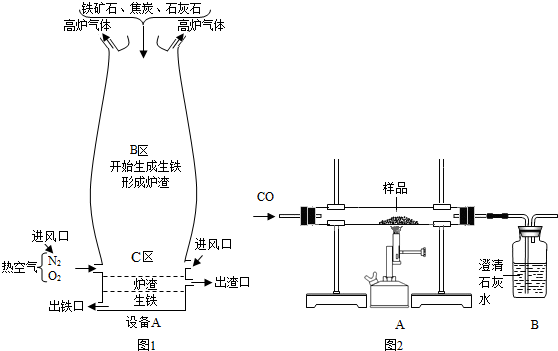
(Ⅰ)如图1是教材中炼铁高炉及炉内化学变化过程示意图,若图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:(1)B区______ (2)C区______、______.
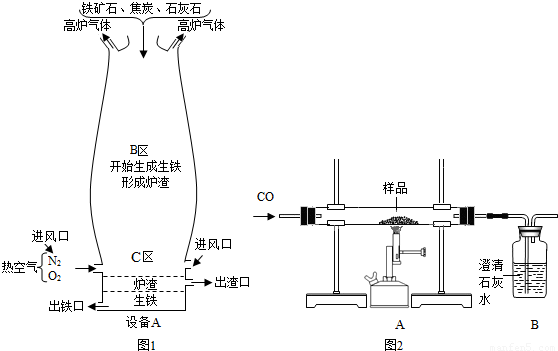
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如图2所示.
(3)该工艺流程中,甲烷的作用是______、______,冶炼出的铁水属于______(填“纯净物”或“混合物”).
(4)该工艺流程中,可循环利用的物质是______.
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原.
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法.

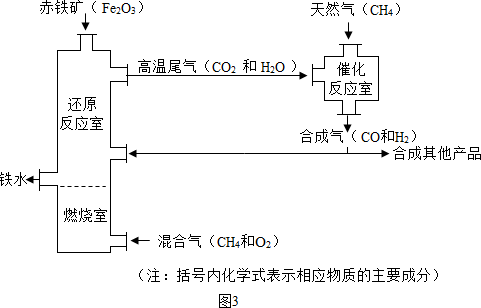
(Ⅳ)某兴趣小组同学利用图3装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32g | 反应前55.72g | 反应前 281.00g |
| 反应后55.08g | 反应后 281.56g |
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是______.
②该样品所有可能的组成是______.
 2Fe+3CO2;
2Fe+3CO2;(2)C区主要是产生一氧化碳共发生了两个反应,方程式为:C+O2
 CO2,CO2+C
CO2,CO2+C 2CO;
2CO;(II)(3)甲烷燃烧放出了大量的热,能够给炼铁提供热量,同时生成了二氧化碳和水,提供了生产合成气的原料;而在炼铁的过程中不可避免的会引入一些杂质,所以冶炼出的铁水属于混合物;
(4)根据甲烷燃烧的产物为二氧化碳和水,而高温尾气的成分也为二氧化碳和水,它们进入催化反应室中可以得到合成气体(一氧化碳和氢气);所以可以判断在该过程中能够被循环利用的物质为二氧化碳和水;
(5)①氧化汞在加热的条件下能够分解产生氧气和汞,该反应的化学方程式为:2HgO
 2Hg+O2↑;C+2CuO
2Hg+O2↑;C+2CuO 2Cu+CO2↑;
2Cu+CO2↑;②碳是具有还原性的单质,可以和金属氧化物反应,例如和氧化铜反应能生成铜和二氧化碳,该反应的化学方程式为:C+2CuO
 2Cu+CO2↑;
2Cu+CO2↑;③利用金属的还原性也可以和金属氧化物反应生成金属单质和另一种金属,例如题给的铝和氧化铁的反应;
(6)①不选用装置B的质量的理由是:装置B不能将反应产生的CO2全部吸收,故答案为:装置B不能将反应产生的CO2全部吸收;
②根据表格数据:氧元素的质量=55.72g-55.08g=0.64g,混合物中氧元素的质量分数=
 ×100%=27.6%,而Fe3O4中含氧元素的质量分数为:
×100%=27.6%,而Fe3O4中含氧元素的质量分数为: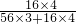 ×100%=27.6%;而Fe2O3中含氧元素飞质量分数为:
×100%=27.6%;而Fe2O3中含氧元素飞质量分数为: ×100%=30%;而FeO中含氧元素的质量分数为:
×100%=30%;而FeO中含氧元素的质量分数为: ×100%=22.2%;根据计算可以知道该物质若含有一种物质,则为Fe3O4;若为混合物,则根据平均值的计算方法可以知道,该混合物中含有的物质至少有一种大于27.6%,且至少有一种物质中含氧元素的质量分数要小于27.6%;所以可能的混合物组合为:①Fe2O3、FeO; ②Fe3O4、Fe2O3、FeO.
×100%=22.2%;根据计算可以知道该物质若含有一种物质,则为Fe3O4;若为混合物,则根据平均值的计算方法可以知道,该混合物中含有的物质至少有一种大于27.6%,且至少有一种物质中含氧元素的质量分数要小于27.6%;所以可能的混合物组合为:①Fe2O3、FeO; ②Fe3O4、Fe2O3、FeO.故答案为:(I)(1)3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;(2)C+O2
 CO22C+CO2
CO22C+CO2 2CO;
2CO;(II)(3)燃烧产生热量、做生产合成气的原料;混合物;
(4)CO2和H2O(高温尾气);
(III)(5)2HgO
 2Hg+O2↑;C+2CuO
2Hg+O2↑;C+2CuO 2Cu+CO2↑;
2Cu+CO2↑;用金属还原金属氧化物;
(Ⅳ)(6)①装置B不能将反应产生的CO2全部吸收;
②Fe3O4;Fe2O3、FeO;Fe3O4、Fe2O3、FeO.
分析:(Ⅰ)依据B区主要是生成铁而C区主要是产生一氧化碳的情况书写即可;
(Ⅱ)(3)根据甲烷燃烧产生的热量及炼铁的原理解答,根据物质的分类标准来判断铁水所属物质的种类;
(4)根据甲烷燃烧的产物和该流程最后所产生的气体来完成解答即可.
(Ⅲ)(5)氧化汞在加热的条件下能够分解产生氧气和汞,碳是具有还原性的单质,可以和金属氧化物反应,例如和氧化铜反应能生成铜和二氧化碳;利用金属的还原性也可以和金属氧化物反应生成金属单质和另一种金属,例如铝和氧化铁的反应,可以据此完成该题的解答;
(Ⅳ)(6)①根据气体和装置的特点来进行分析并完成解答;
②根据试管A中物质反应前后质量变化来判断反应物中氧元素的质量,然后结合氧化铁、氧化亚铁和四氧化三铁中氧元素的质量采用平均值的方法来进行分析即可.
点评:本考点考查了铁的冶炼,是结合课本知识的信息.炼铁的原理是用还原剂一氧化碳把铁从它的氧化物中还原出来,因为一氧化碳有毒,因此要进行尾气处理.本题还考查了实验数据的处理,并对实验进行了评价,是中考考查的重点之一,本考点一般出现在实验题中.

铁的冶炼是钢铁工业的基础。
(Ⅰ)右图是教材中炼铁高炉及炉内化学变化过程示意图,若右图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:
(1) B区 (2) C区 、 。
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如下图所示。
(3)该工艺流程中,甲烷的作用是 、 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(4)该工艺流程中,可循环利用的物质是 。
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。
(Ⅳ)某兴趣小组同学利用下图装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32 g | 反应前55.72 g | 反应前 281.00 g |
| 反应后55.08 g | 反应后 281.56 g |
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是 。
②该样品所有可能的组成是 。
铁的冶炼是钢铁工业的基础。
(Ⅰ)右图是教材中炼铁高炉及炉内化学变化过程示意图,若右图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:

(1) B区 (2) C区 、 。
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如下图所示。

(3)该工艺流程中,甲烷的作用是 、 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(4)该工艺流程中,可循环利用的物质是 。
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。

(Ⅳ)某兴趣小组同学利用下图装置进行相关实验,测定样品的组成:

(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
|
样品质量 |
装置A中玻璃管和固体的总质量 |
装置B的质量 |
|
2.32 g |
反应前55.72 g |
反应前 281.00 g |
|
反应后55.08 g |
反应后 281.56 g |
请回答下列问题:
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是 。
②该样品所有可能的组成是 。