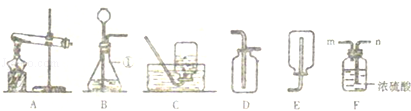题目内容
实验探究氢气遇到氧气发生爆炸的条件:
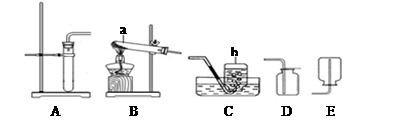
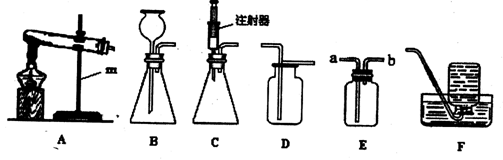
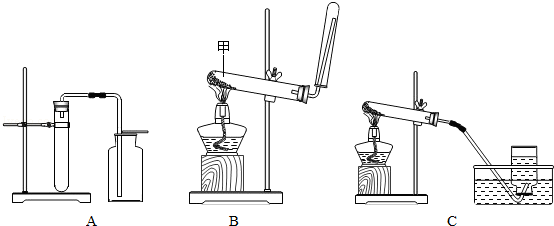
(1)甲装置中仪器“A”的名称是 ;在实验室中利用氯酸钾和二氧化锰制取氧气,发生的化学方程式是 ;利用锌粒和稀硫酸制取氢气,可以利用下列 (选填“甲”或“乙”)装置;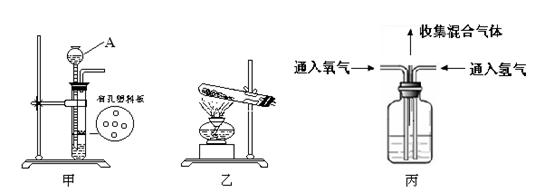
(2)利用丙装置将氢气、氧气混合气体收集起来,可以观察 数量,通过活塞控制两者气体的比例关系,利用一次性保鲜袋收集混合气体,然后直接点燃保鲜袋。
(3)实验共四次,实验数据及现象记录在下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 氢气与氧气的体积比 | 1︰2 | 1︰4 | 1︰19 | 1︰39 |
| 氢气的体积百分数 | 33% | 20% | 5% | 3.3% |
| 点燃后现象 | 爆炸 | 爆炸 | 爆炸 | 保鲜袋燃烧,没有爆炸 |
由此可见氢气与氧气混合发生爆炸,除要达到燃烧的三个条件外,还和 有关。
(1)长颈漏斗 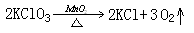 甲
甲
(2)气泡
(3)氢气和氧气的体积比(或:氢气的体积百分数)
解析试题分析:根据仪器的用途和形态确定仪器的名称;氯酸钾和二氧化锰制取氧气的反应中氯酸钾是反应物,二氧化锰是这个反应的催化剂,同时这个反应发生还需要加热的条件,根据这些信息书写化学方程式;锌是固体,稀硫酸是液体,反应不需要加热,所以制取氢气的发生装置应选择A固液不加热型装置;氢氧两种气体在水中经过时都会产生气泡,可以根据产生气泡的多少来判断它们产生气体的数量;爆炸除了要达到燃烧的条件外,还要达到可燃物的爆炸极限即氢气和氧气的体积比。
考点:氢气的制取与性质,化学方程式的书写。

练习册系列答案
相关题目