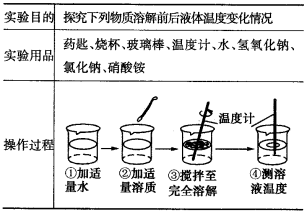
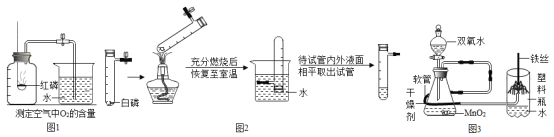
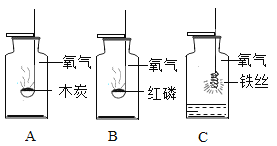
题目内容
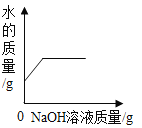
【题目】如图是A、B、C三种物质的溶解度曲线,请回答:
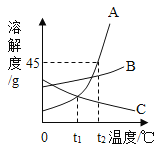
(1)在t2℃时,A、B、C三种物质的饱和溶液中溶质的质量分数由大到小的顺序为_____。
(2)将t2℃三种物质的饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是_____。
(3)要使接近饱和的C溶液变成饱和溶液,可采用的方法有_____(写出一种)。
(4)t2℃时,将30g A放入50g水中,所得溶液溶质的质量分数为_____(精确至0.1%)。
(5)写出一组符合图中趋势的三种物质的化学式,A_____,B_____,C_____。
【答案】ABC BAC 增加溶质 31.0% KNO3 NaCl Ca(OH)2
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
(1)据图可以看出,在t2℃时,A、B、C三种物质的溶解度大小关系为A>B>C,故饱和溶液中溶质的质量分数由大到小的顺序为 ABC,故填:ABC;。
(2)将t2℃三种物质的饱和溶液降温至t1℃时,AB的溶解度减小会析出晶体,在t1℃时B的溶解度大于A,故B的溶质质量分数大于A,C的溶解度增大,故溶液组成不变,溶质质量分数最小,故三种溶液的溶质的质量分数由大到小的顺序是 BAC,故填:BAC。
(3)要使接近饱和的C溶液变成饱和溶液,可采用增加溶质的方法,故填:增加溶质;
(4)t2℃时, 50g水中只能溶解22.5gA,所得溶液溶质的质量分数为![]() 。
。
(5)A的溶解度随温度的升高增大明显,可以是硝酸钾,B的溶解度随温度的升高变化不大,故可以是氯化钠,C的溶解度随温度的升高而减小,氢氧化钙的溶解度变化特点与此相同,故填:KNO3;NaCl;Ca(OH)2。

【题目】下图是元素周期表的一部分,请根据表中提供的信息按要求填空:
3Li | 4Be | 5B | ① | 7N | ② | 9F | 10Ne |
③ | 12Mg | ④ | 14Si | ⑤ | 16S | 17Cl | 18Ar |
(1)由⑤元素组成的单质在空气中燃烧的化学方程式为 。
(2)由①②③三种元素组成的物质为 。
(3)在元素周期表中,同一行元素最外层电子数的变化规律是 。