题目内容
25、某同学在自主学习金属的知识时,设计以下实验报告,请将该实验报告补充完整.
【实验目的】
【实验用品】铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
【实验内容】
【实验思考】通过上述实验,能否证明Fe、Cu、Ag三种金属的活动性顺序?并说明理由:
【实验目的】
探究金属的化学性质
.【实验用品】铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
【实验内容】
| 实验步骤 | 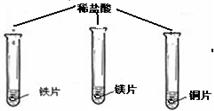 (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中) (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中) |
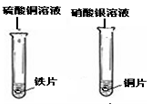 |
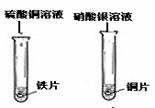
| 实验现象 | 铁片和镁带表面都有气泡产生, 铜片表面却没有明显现象. |
铁片表面有 亮红色固体析出; ,铜片表面有银白色固体析出. |
| 分析 结论 |
铁与稀盐酸反应的化学方程式: Fe+2HCl═FeCl2+H2↑ ,活泼金属能与酸(稀盐酸)反应. |
铁与硫酸铜溶液反应的化学方程式: Fe+CuSO4═FeSO4+Cu ,某些金属能与盐溶液发生反应. |
能.铁能与酸反应,铜不与酸反应,说明活动性铁>氢>铜;铜能置换出硝酸银溶液中的银,说明活动性铜>银,所以活动性铁>氢>铜>银.
.分析:[实验目的]根据实验的过程及过程中对药品的要求、实验后所做分析与结论,可判断设计该实验的目的;
[实验内容]实验现象:根据铁能置换出硫酸铜中的铜,析出的铜呈红色会覆盖在铁的表面,预计实验的现象;
分析:铁能与稀盐酸、硫酸铜溶液发生置换反应,反应生成亚铁盐;
[实验思考]根据实验中与铁、铜、银相关的实验现象,可以判断出三种金属的活动性强弱关系.
[实验内容]实验现象:根据铁能置换出硫酸铜中的铜,析出的铜呈红色会覆盖在铁的表面,预计实验的现象;
分析:铁能与稀盐酸、硫酸铜溶液发生置换反应,反应生成亚铁盐;
[实验思考]根据实验中与铁、铜、银相关的实验现象,可以判断出三种金属的活动性强弱关系.
解答:解:[实验目的]根据实验的内容:三种金属分别与酸反应、金属与盐溶液反应,及实验所得的结论,可以判断该实验在探究金属的化学性质或者具体点说究金属与酸和盐溶液的反应;
故答案为:探究金属的的化学性质(或研究金属与酸和盐溶液反应);
[填写实验报告]①铁片与硫酸铜溶液发生置换反应,生成的红色铜覆盖在铁的表面,因此,可观察到表片表现出现光亮的红色固体;
故答案为:亮红色固体析出;
②铁能与稀盐酸发生置换反应,生成氯化亚铁和氢气;
故答案为:Fe+2HCl═FeCl2+H2↑;
③铁也能与硫酸铜溶液发生置换反应,生成硫酸亚铁和红色的铜;
故答案为:Fe+CuSO4═FeSO4+Cu;
[实验思考]根据铁、铜与稀盐酸反应的现象或铁与硫酸铜溶液的反应,可判断铁与铜的活动性强弱关系;根据铜与硝酸银溶液的反应现象,可判断铜与银的活动性强弱;综合以上现象,即可判断铁、铜、银三种金属的活动性强弱关系;所以通过上述实验,能证明Fe、Cu、Ag三种金属的活动性顺序;
故答案为:能;铁能与酸反应,铜不与酸反应,说明活动性铁>氢>铜;铜能置换出硝酸银溶液中的银,说明活动性铜>银,所以活动性铁>氢>铜>银
故答案为:探究金属的的化学性质(或研究金属与酸和盐溶液反应);
[填写实验报告]①铁片与硫酸铜溶液发生置换反应,生成的红色铜覆盖在铁的表面,因此,可观察到表片表现出现光亮的红色固体;
故答案为:亮红色固体析出;
②铁能与稀盐酸发生置换反应,生成氯化亚铁和氢气;
故答案为:Fe+2HCl═FeCl2+H2↑;
③铁也能与硫酸铜溶液发生置换反应,生成硫酸亚铁和红色的铜;
故答案为:Fe+CuSO4═FeSO4+Cu;
[实验思考]根据铁、铜与稀盐酸反应的现象或铁与硫酸铜溶液的反应,可判断铁与铜的活动性强弱关系;根据铜与硝酸银溶液的反应现象,可判断铜与银的活动性强弱;综合以上现象,即可判断铁、铜、银三种金属的活动性强弱关系;所以通过上述实验,能证明Fe、Cu、Ag三种金属的活动性顺序;
故答案为:能;铁能与酸反应,铜不与酸反应,说明活动性铁>氢>铜;铜能置换出硝酸银溶液中的银,说明活动性铜>银,所以活动性铁>氢>铜>银
点评:根据金属与酸反应能否放出氢气或产生氢气的快慢、金属与盐溶液反应是否能置换出金属,可以检验金属的活动性的强弱.

练习册系列答案
相关题目
某同学在自主学习金属的知识时,设计以下实验报告,请将该实验报告补充完整.
【实验目的】________.
【实验用品】铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
【实验内容】
| 实验步骤 |  (在同温下,去大小相同、光亮的三种金属薄片铁、镁、铜,投入等体积、等浓度的足量稀盐酸中) |  把铁片加入硫酸铜溶液,铜片加入硝酸银溶液 |
| 实验现象 | 铁片表面有________,铜片表面有银白色固体析出 | |
| 分析结论 | 铁与稀盐酸反应的化学方程式: ________, 活泼金属能与酸反应 | 铁与硫酸铜反应的化学方程式: ________, 某些金属能与盐溶液发生反应. |
________.
8.某同学在自主学习金属的知识时,设计以下实验报告,请将该实验报告补充完整。
【实验目的】 。
【实验用品】铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
【实验内容】
| 实验步骤 |
|
|
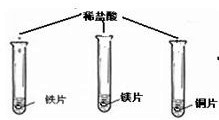
| 实验现象 | 铁片和镁带表面都有气泡产生, 铜片表面却没有明显现象。 | 铁片表面有 ,铜片表面有银白色固体析出。 |
| 分析 结论 | 铁与稀盐酸反应的化学方程式: , 活泼金属能与酸(稀盐酸)反应。 | 铁与硫酸铜溶液反应的化学方程式: , 某些金属能与盐溶液发生反应 。 |
【实验思考】通过上述实验,能否证明Fe、Cu、Ag三种金属的活动性顺序?并说明理由:
。


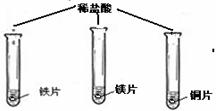 (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中)
(在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中)