题目内容
8.某同学在自主学习金属的知识时,设计以下实验报告,请将该实验报告补充完整。
【实验目的】 。
【实验用品】铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
【实验内容】
| 实验步骤 |
|
|
| 实验现象 | 铁片和镁带表面都有气泡产生, 铜片表面却没有明显现象。 | 铁片表面有 ,铜片表面有银白色固体析出。 |
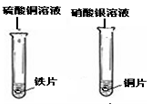
| 分析 结论 | 铁与稀盐酸反应的化学方程式: , 活泼金属能与酸(稀盐酸)反应。 | 铁与硫酸铜溶液反应的化学方程式: , 某些金属能与盐溶液发生反应 。 |
【实验思考】通过上述实验,能否证明Fe、Cu、Ag三种金属的活动性顺序?并说明理由:
。
答案:探究金属的化学性质(或研究金属与酸和盐溶液反应)
Mg +2HCl →MgCl2+H2↑ 亮红色固体析出 Fe+ CuSO4 →Fe SO4+Cu
能。铁能与酸反应,铜不与酸反应,说明活动性铁>氢>铜;铜能置换出硝酸银溶液中的银,说明活动性铜>银,所以活动性铁>氢>铜>银。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
某同学在自主学习金属的知识时,设计以下实验报告,请将该实验报告补充完整.
【实验目的】________.
【实验用品】铁片、铜片、镁片、稀盐酸、硫酸铜溶液、硝酸银溶液
【实验内容】
| 实验步骤 |  (在同温下,去大小相同、光亮的三种金属薄片铁、镁、铜,投入等体积、等浓度的足量稀盐酸中) |  把铁片加入硫酸铜溶液,铜片加入硝酸银溶液 |
| 实验现象 | 铁片表面有________,铜片表面有银白色固体析出 | |
| 分析结论 | 铁与稀盐酸反应的化学方程式: ________, 活泼金属能与酸反应 | 铁与硫酸铜反应的化学方程式: ________, 某些金属能与盐溶液发生反应. |
________.
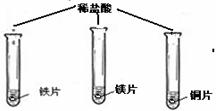 (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中)
(在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中)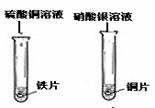
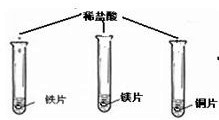

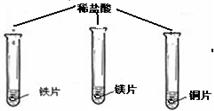 (在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中)
(在同温下,取大小相同、光亮的三种金属薄片,投入等体积、等浓度的足量稀盐酸中)