��Ŀ����
����Ŀ��̽��п������ϡ���ᷴӦ�IJ����ԣ�������ͼʵ�顣
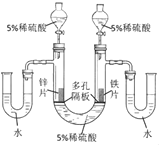
(1)��98%��Ũ��������5%��ϡ������Һ100g��Ϊȷ��ȡŨ������������Ӧ���ĵ�������___��
(2)ȡ����������ͬ��пƬ����Ƭ��ԭ����___������ϡ���ᷴӦ�Ļ�ѧ����ʽ___��
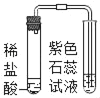
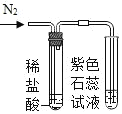
(3)ȡ������пƬ����Ƭ���ڶ�����ϣ���5%ϡ����Һ�治�Ӵ�(��ͼ)��ͬʱ������������������5%ϡ���ᣬ�м�U�ι��ڷ�Ӧ���ڹ۲쵽��������__��__����Ӧ����ʱ���۲쵽��������__��
(4)��ʵ��ó��Ľ����Ǣ�___��___��
���𰸡�98%��Ũ������ܶ� ���Ʊ��� Fe+H2SO4=FeSO4+H2�� пƬ����������ݵ����ʱ���Ƭ�� ��Ƭ�·���Һ��Ϊdz��ɫ��Һ������ҵ� п�������� ��������п���������������ᷴӦ���������������϶�
��������
��1����һ��������98����Ũ���ỻ���������������=![]() ��֪����Ҫ����98%��Ũ������ܶȣ�����98%��Ũ������ܶȡ�
��֪����Ҫ����98%��Ũ������ܶȣ�����98%��Ũ������ܶȡ�
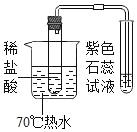
��2��̽��п������ϡ���ᷴӦ�IJ�����ʱ��Ӧȡ����������ͬ��пƬ����Ƭ�μӷ�Ӧ��������Ϊһ�ֱ仯�ܶ�������Ӱ�죬̽������һ�����ص�Ӱ�췽ʽʱ���������ر��ֲ��䣬���ַ����ǿ��Ʊ�����������Ʊ�����
����ϡ���ᷴӦ���������������������ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Fe+H2SO4=FeSO4+H2����
��3��п�Ļ�Ա���ǿ�����Խ���п��ϡ���ᷴӦ���������Ա�����ϡ���ᷴӦ�����ʿ죬�۲쵽��������пƬ����������ݵ����ʱ���Ƭ�죬����пƬ����������ݵ����ʱ���Ƭ�죻
��������п�������������ᷴӦ�������ᷴӦ���ɵ���������������п���ᷴӦ���ɵ��������������������ᷴӦ���ɵ��Ȼ���������ˮ��Һ��dz��ɫ�����Թ۲쵽����������Ƭ�·���Һ��Ϊdz��ɫ��Һ������ҵͣ�������Ƭ�·���Һ��Ϊdz��ɫ��Һ������ҵ͡�
��4�������������֪��пƬ����������ݵ����ʱ���Ƭ�죬˵��п�Ļ��ǿ��������Ӧ���м�U�ι��е�Һ������ҵͣ�˵����������п���������������ᷴӦ���������������϶࣬����п�������ã���������п���������������ᷴӦ���������������϶ࡣ

����Ŀ����ͬѧ����ͼ��ʾװ���Ƶ�CO2������֤CO2����ˮ��Ӧ����������ʡ�
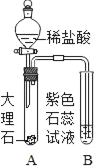
B�Թܷ�����������_____����Ӧ����ʽ��_____��
��ͬѧ��ʵ��ʱ�ŵ��Ƶõ�CO2��Щ�̼�����ζ��������ͬѧ����ζ����Դ�Լ���ʹ��ɫʯ����Һ�����������ʽ�������̽����
���������ϣ�����ʯ��ϡ���ᷴӦ��������������ʯ����ζ��ϡ�����д̼�����ζ��
��������룩�̼�����ζ��Դ��ϡ���ᣬ���һ����룺
I���¶��й� II��_____ III���¶ȼ������������й�
������ʵ�飩ʵ��װ�����£�����ʵ��������ϡ���ἰ��ɫʯ����Һ����������ʵ�������������ͬ���г�װ������ȥ����
��� | ʵ��װ�ü����� | ʵ����������� |
1 |
| һ��ʱ���������� |
2 |
| ��ɫʯ����Һ��죬_____������ |
3 |
| _____������II���������ϲ���III������ |
����չ��˼����
��1������װ��A��B֮������װ��C��װ��C��������_____��װ��C��ҩƷӦ���е�������_____��
��2����ʵ��1��ϡ�����ΪŨ���ᣬ��ɫʯ����Һ��죬˵��Ũ������е�����������_____��
��3����ͬѧ��Ϊʵ��1����ʡȥ����Ҳ������֤���롣��Ĺ۵���_____����ܡ����ܡ�����֤���롣