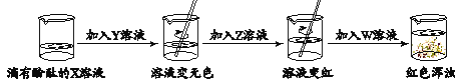
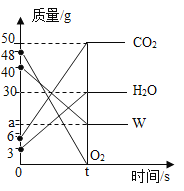
题目内容
【题目】下图是有关稀盐酸和氢氧化钠溶液发生化学反应的微观示意图。请回答下列问题:
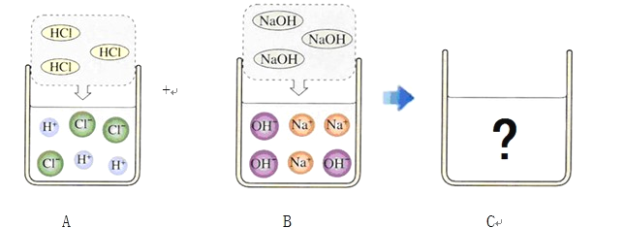
(1)A中溶液能使紫色石蕊溶液显红色,因为其中含有较多的(填粒子符号)________;B中溶液能使无色酚酞溶液显________色,因为其中含有较多的(填粒子符号)________。
(2)将50 g 7.3% 的A中的溶液与50 g 8% 的B中的溶液混合,得到C中的溶液,其中主要含有的粒子是(填粒子符号)________;C中的溶液中溶质的质量分数是________ 。
【答案】H+红OH-Na+ Cl- H2O5.85%
【解析】
试题(1)酸的溶液能使石蕊变红,是因为含有氢离子的缘故;碱的溶液能使酚酞变红,是因为氢氧根离子的缘故。
(2)氢氧化钠与盐酸反应时的方程式是:NaOH+HCl=NaCl+H2O,两者反应时的质量比是40:36.5,50g 7.3% 的盐酸与50g 8% 的氢氧化钠溶液,所含溶质的质量比正好与之相等,也就是说两者恰好反应,则溶质是氯化钠,溶剂是水,所以溶液中的粒子主要是氯离子、钠离子与水分子。
设生成氯化钠的质量是x
NaOH+HCl=NaCl+H2O
40 58.5
50g×8% x
40:58.5=50g×8%:x
解得,x=5.85g
则C中的溶液中溶质的质量分数是=![]() ×100%=5.85%
×100%=5.85%

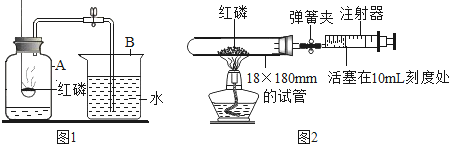
【题目】某小组同学在用过氧化氢溶液与MnO2制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。为此,他们进行了如下探究:
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与MnO2的质量有关。
(进行实验)
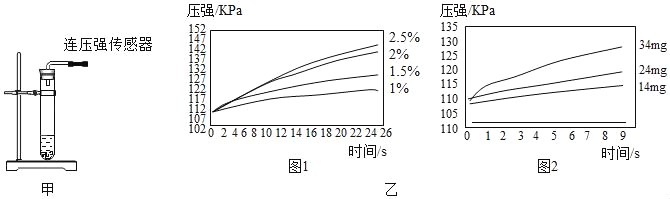
根据图甲进行如下实验。
实验1:用26mg MnO2与5mL不同浓度过氧化氢溶液进行实验,压强变化如乙图1。
实验2:用5mL 1.5%过氧化氢溶液与不同质量MnO2进行实验,压强变化如乙图2。
(解释与结论)
(1)过氧化氢溶液制取氧气的化学方程式为_______________。
(2)实验1得到的结论是___________________________。实验2的目的是_________。
欲得出“MnO2对过氧化氢分解有催化作用”的结论,需要对比____________。(简要的写出实验设想)
(3)小组同学通过互联网得知:多种物质能催化过氧化氢的分解。
(实验探究)
实验证明,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42﹣ ),稀硫酸中含有三种粒子(H2O、H+、SO42﹣ )为了进一步探究CuSO4,溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H2O,他们的理由是____________。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a 取一支试管加入5mL 5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有 气泡放出 | 验证明,起催化作用的是______。 |
b.另取一支试管加入5mL 5%过氧化氢溶液,然后加入2﹣3滴硫酸铜溶液 | 溶液中有大量气泡放出 |
(反思与评价)
(4)小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是__________、_________。
(5)利用图甲装置探究“温度对过氧化氢分解速率”的影响,是否合理?_____。理由是________。
【题目】在下表内填写符合要求的化学符号.
符号表示的意义 | 五个氧分子 | 硅元素 | 铁离子 | 氧化锌中锌 元素显正二价 | 四个硫原子 |
化学符号 | ________ | ________ | ________ | ________ | ________ |