题目内容
【题目】实验室常用过氧化氢溶液和二氧化锰制氧气,回答下列问题:
(1)为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去), 
进行了两次实验,两次实验的部分设计如表所示:
实验1 | 实验2 | |
MnO2的质量 | 0.5克 | 0.5克 |
5%的H2O2溶液体积 | 40mL | 待填 |
水浴温度 | 20℃ | 80℃ |
①此反应的符号表达式是
②实验2中“待填”的数据是毫升;在两次实验中,可以通过一定时间内内的的多少来精确比较H2O2分解反应速率的大小.
③实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还可能的原因有 .
④实验结束后若要将不溶于水的MnO2从剩余物中分离出来,实验操作步骤(简单描述)是→用水冲洗MnO2→烘干二氧化锰.
(2)探究使带火星木条复燃的氧气的最低浓度.用容积为300mL的集气瓶排水法收集氧气,当刚好把瓶中预先留有的100mL水排尽时,集气瓶中氧气的体积分数为(写出计算式即可): .
实验研究结果显示:O2的体积分数大于49%时就可使带火星的木条复燃.因此,用带火星的木条验满O2的方法(填“可靠”或“不可靠”).为此,收集O2时最好使用集气法(不需要验满).
【答案】
(1)2H2O2 ![]() 2H2O+O2↑;0;注射器;气体体积;温度高时,水变成水蒸汽;过滤
2H2O+O2↑;0;注射器;气体体积;温度高时,水变成水蒸汽;过滤
(2)(100+200×21%)÷300×100%;不可靠;排水
【解析】解:(1)①过氧化氢分解生成水和氧气,反应的符号表达式是2H2O2 ![]() 2H2O+O2↑;②利用对比试验探究温度对H2O2分解反应速率的影响时,变量应是温度,其余的量应相同,所以,实验2中应加入5%H2O240毫升;在两次实验中,可以通过一定时间内注射器内的气体体积的多少来精确比较H2O2分解反应速率的大小;③实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气;④实验结束后若要将MnO2从混合物汇总分离出来,由于MnO2不溶于水,可采取的方法是过滤、洗涤、干燥;(2)空气中氧气的体积含量为21%,所以用容积为300mL的集气瓶排水法收集氧气,当刚好把瓶中预先留有的100mL水排尽时,集气瓶中氧气的体积分数为:(100+200×21%)÷300×100%;
2H2O+O2↑;②利用对比试验探究温度对H2O2分解反应速率的影响时,变量应是温度,其余的量应相同,所以,实验2中应加入5%H2O240毫升;在两次实验中,可以通过一定时间内注射器内的气体体积的多少来精确比较H2O2分解反应速率的大小;③实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气;④实验结束后若要将MnO2从混合物汇总分离出来,由于MnO2不溶于水,可采取的方法是过滤、洗涤、干燥;(2)空气中氧气的体积含量为21%,所以用容积为300mL的集气瓶排水法收集氧气,当刚好把瓶中预先留有的100mL水排尽时,集气瓶中氧气的体积分数为:(100+200×21%)÷300×100%;
O2的体积分数大于49%时就可使带火星的木条复燃.因此,用带火星的木条验满O2的方法不可靠,为此,收集O2时最好使用排水集气法.(1)①2H2O2 ![]() 2H2O+O2↑;②40;注射器;气体体积;③温度高时,水变成水蒸汽;④过滤;(2)(100+200×21%)÷300×100%;不可靠;排水.
2H2O+O2↑;②40;注射器;气体体积;③温度高时,水变成水蒸汽;④过滤;(2)(100+200×21%)÷300×100%;不可靠;排水.
(1)①根据过氧化氢分解生成水和氧气进行解答;②根据对比实验探究温度对H2O2分解反应速率影响的方法分析;根据相同的时间内产生气体的多少分析;③根据温度高时水蒸发成水蒸气分析;④根据混合物的组成特点分析分离提纯MnO2的方法;(2)根据空气中氧气的体积含量为21%以及排水法收集气体的气体较纯进行解答.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验. 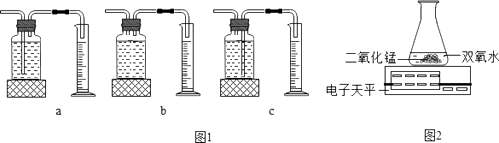
(1)为探究催化剂的种类对双氧水分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g 10%H2O2溶液与1.0g MnO2均匀混合
Ⅱ.将x g10% H2O2溶液与1.0g CuO均匀混合
在相同温度下,比较两组实验产生O2的快慢.
Ⅰ中反应的化学(符号)表达式是;
Ⅱ中x的值应为 .
(2)乙探究了影响双氧水分解速度的某种因素.实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是(填编号).
实验结论:在相同条件下, , 双氧水分解得越快.丙用如图装置进行实验,通过比较也能达到实验目的.